Презентация на тему: Серная кислота и её свойства

СЕРНАЯ КИСЛОТА и её СВОЙСТВА СПОСОБЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ВАСИЛИЙ КАДЕВИЧ 2008 900igr.net

Единственный путь, ведущий к знанию, - это деятельность Б. Шоу

Птицы еще в яйце изучают географию. Как пролететь из Европы в Африку, как из Америки вернуться в Европу – все это известно им еще в яйце. А как же иначе? Ведь прежде чем отращивать крылья, нужно знать, куда полетишь. А если не знаешь, куда полетишь, - незачем отращивать крылья.

Что Вы знаете или думаете, что знаете о серной кислоте? ЗНАЮ ХОЧУ УЗНАТЬ УЗНАЛ
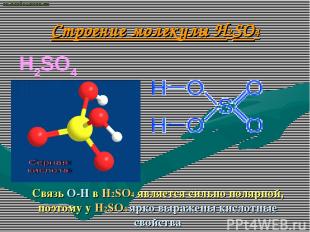
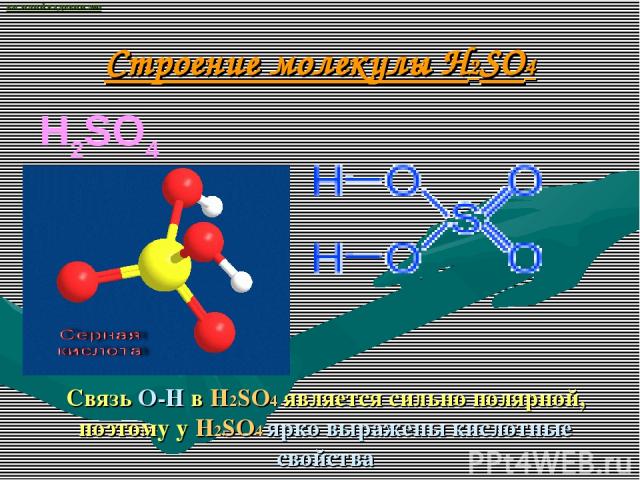
Строение молекулы H2SO4 H2SO4 Связь О-Н в H2SO4 является сильно полярной, поэтому у H2SO4 ярко выражены кислотные свойства ВАСИЛИЙ КАДЕВИЧ 2008

Физические свойства Тяжелая маслянистая жидкость ("купоросное масло"); p = 1,84 г/см3; Нелетучая, хорошо растворима в воде – с сильным нагревом; t°пл. = 10,3°C, t°кип. = 296°С, Очень гигроскопична, обладает водоотнимающими свойствами ВАСИЛИЙ КАДЕВИЧ 2008

Лабораторный опыт № 7 Исследование химических свойств раствора серной кислоты ВНИМАНИЕ ! При работе с кислотой будьте осторожны. При попадании на руки тщательно вымойте их водой, при необходимости - нейтрализуйте раствором соды.

В пробирках в виде растворов представлены вещества: NaCl, NaBr, NaI, NaF, H2SO4, Na2CO3, Na2SO4, NaOH Предложите план идентификации данных веществ. Укажите качественную реакцию на серную кислоту и ее соли

Если эти утверждения верны на Ваш взгляд, то напротив них поставьте знак «+», а если нет, то знак «-» 1. Свойства концентрированной серной кислоты обусловлены тем, что степень окисления серы в ней равна +6 2. Концентрированная серная кислота является восстановителем. 3. Концентрированную серную кислоту нельзя перевозить в стальных цистернах, т.к. в состав стали входит железо 4. Концентрированная серная кислота не взаимодействует с металлами, стоящими после водорода. 5. Концентрированная серная кислота взаимодействует с неметаллами 6. Концентрированная серная кислота диссоциирует практически полностью с образованием ионов водорода и сульфат-ионов. 7. Продукты восстановления серы в серной кислоте могут быть со степенями окисления +4, -2. 8. Алюминий в концентрированной серной кислоте разрушается. 9. На органические вещества концентрированная серная кислота не действует 10. Концентрированная серная кислота может вытеснять другие кислоты из их солей

Химические свойства H2SO4 - сильная двухосновная кислота H2SO4 H+ + HSO4- 2H+ + SO42- 1) Взаимодействие с металлами: разбавленная серная кислота растворяет только металлы, стоящие в ряду напряжений левее водорода: Zn0 + H2+1SO4(разб) => Zn+2SO4 + H2 2) с основными оксидами: CuO + H2SO4 => CuSO4 + H2O CuO + 2H+ => Cu2+ + H2O ВАСИЛИЙ КАДЕВИЧ 2008

3) с основаниями: H2SO4 + 2NaOH => Na2SO4 + 2H2O H+ + OH- => H2O H2SO4 + Cu(OH)2 => CuSO4 + 2H2O 2H+ + Cu(OH)2 => Cu2+ + 2H2O 4) обменные реакции с солями: MgCO3 + H2SO4 => MgSO4 +H2O + CO2 MgCO3 + 2H+ => Mg2+ + H2O + CO2 BaCl2 + H2SO4 => BaSO4↓ + 2HCl Ba2+ + SO42- => BaSO4↓ Образование белого осадка BaSO4 (нерастворимого в кислотах) используется для идентификации серной кислоты и растворимых сульфатов. ВАСИЛИЙ КАДЕВИЧ 2008

ВАСИЛИЙ КАДЕВИЧ 2008 5) концентрированная H2+6SO4 – сильный окислитель; при взаимодействии с металлами (кроме Au, Pt) может восстанавливаться до S+4O2, S0 или H2S-2 (без нагревания не реагируют с Fe; Al, Cr - пассивируются): 2Ag0 + 2H2 +6SO4 => Ag2+1SO4 + S+4O2 + 2H2O 8Na0 + 5H2 +6SO4 => 4Na2+1SO4 + H2S-2 + 4H2O Чем более активен металл, тем более полно восстанавливается сера

6) концентрированная H2S+6O4 реагирует при нагревании с некоторыми неметаллами за счет своих сильных окислительных свойств, превращаясь в соединения серы более низкой степени окисления, (например, S+4O2): С0 + 2H2S+6O4(конц) => C+4O2 + 2S+4O2 + 2H2O S0 + 2H2S+6O4(конц) => 3S+4O2 + 2H2O 2P0 + 5H2S+6O4(конц) => 5S+4O2 + 2H3P+5O4 + 2H2O ВАСИЛИЙ КАДЕВИЧ 2008

6) Гигроскопичность серной кислоты Концентрированная серная кислота жадно набирает воду отовсюду, образуя гидраты, и способна для этого даже разрушать молекулы. Древесина состоит из множества органических веществ, среди которых – целлюлоза (C6H7O2(OH)3)n . Концентрированная серная кислота разрушает органические молекулы, отнимая водород и кислород – составляющие воды. Разрушение органических молекул сопровождается выделением свободного углерода. Поэтому лучинка при соприкосновении с концентрированной серной кислотой чернеет, обугливается. Кислота ведет себя, как обезвоживающий агент. ВАСИЛИЙ КАДЕВИЧ 2008

Концентрированная серная кислота энергично обугливает сахарозу


Помните! При приготовлении раствора кислоту вливать малыми порциями в воду, а не наоборот!

Производство серной кислоты 1-я стадия. Печь для обжига колчедана. 4FeS2 + 11O2 => 2Fe2O3 + 8SO2 + Q 2-я стадия. Окисление сернистого газа до серного ангидрида (450°С – 500°С; катализатор V2O5): 2SO2 + O2 2SO3 3-я стадия. Поглощение серного ангидрида nSO3 + H2SO4(конц)=>(H2SO4 • nSO3)(олеум) ВАСИЛИЙ КАДЕВИЧ 2008

ВАСИЛИЙ КАДЕВИЧ 2008 Применение H2SO4 В производстве пластмассы В производстве синтетического волокна В средствах защиты растений В моющих средствах В лекарствах В красителях и пигментах В производстве взрывчатых веществ Электролит в аккумуляторах В очистке нефтепродуктов В получении солей и кислот В металлургии В минеральных удобрениях

СОЛИ СЕРНОЙ КИСЛОТЫ CaSO4• 2H2O - гипс CaSO4• 0,5H2O - алебастр CuSO4• 5H2O – медный купорос Na2SO4• 10H2O – мирабилит (глауберова соль) MgSO4• 7H2O – горькая соль К2SO4• Al2(SO4)3 • 24H2O – алюмокалиевые квасцы

… А знаете, товарищи, - объявил он, - эти статуи кто-то облил уксусной кислотой. Кислота разъела гипс, и он за ночь отвалился. Повесть М. Кравцова «Зашифрованный план» Вы бы с этим объяснением согласились? Уточнили бы что-то? Может отвергли бы это объяснение?

Мирабилит в заливе начинает кристаллизоваться в половине ноября, а к половине марта кристаллизация прекращается и начинается обратный процесс – растворение мирабилита в воде. В связи с этим мирабилит был назван «периодическим минералом» К. Паустовский «Кара-Бугаз» Тонкие вопросы Толстые вопросы Что?.. Как?.. Когда?.. Почему?.. От чего зависит?.. С чем связано?.. Ем можно объяснить?..

Домашнее задание Составьте инструкцию по правилам обращения с серной кислотой • для лаборанта кабинета химии; • для автолюбителя, который собирается приготовить раствор серной кислоты в качестве электролита для аккумулятора своего авто; • для хозяйки, которая в магазине «Хозтовары» покупает концентрированную серную кислоту для и планирует почистить ею ванну, чайник от известкового налета. Изучить § 34, упражнения 3,8,10 стр. 223 Опорный конспект на сайте гимназии: Сайт гимназии: http://gim1.grodno.unibel.by Кафедра естественно- математических наук. Кабинет химии.

СПАСИБО ЗА СОТРУДНИЧЕСТВО ВАСИЛИЙ КАДЕВИЧ 2008