Презентация на тему: Серная кислота 1

Тема урока: Серная кислота Химические свойства и получение серной кислоты в промышленности 900igr.net

Цель урока Изучить химические свойства и стадии получения серной кислоты
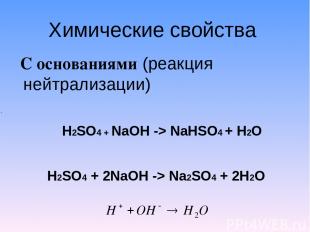
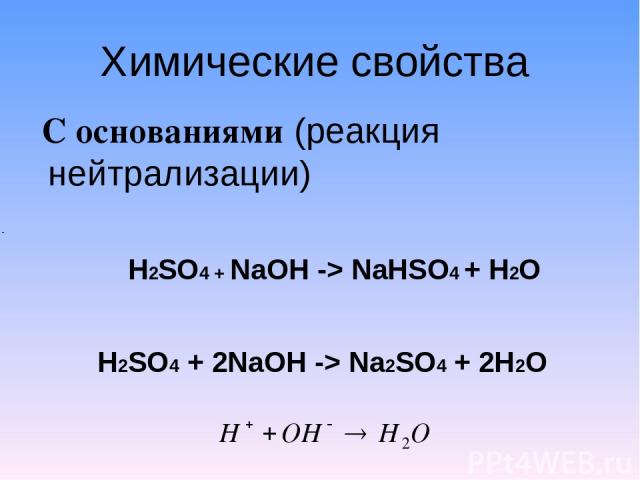
Химические свойства С основаниями (реакция нейтрализации) H2SO4 + NaOH -> NaHSO4 + H2O H2SO4 + 2NaOH -> Na2SO4 + 2H2O

Химические свойства С металлами (стоящие в ряду напряжения до водорода) Zn + H2SO4 -> ZnSO4 + H2

Химические свойства С солями BaCl2 + H2SO4 -> BaSO4 + 2HCl Хлорид бария является качественным реактивом на H2SO4

Концентрированная серная кислота Cu + 2H2SO4 -> CuSO4 + SO2 + 2H2O
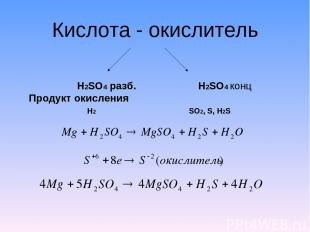
Кислота - окислитель H2SO4 разб. H2SO4 конц Продукт окисления H2 SO2, S, H2S

Производство серной кислоты I стадия – получение сернистого газа SO2 Получение из пирита

Производство серной кислоты II стадия – получение SO3 2-я стадия

Производство серной кислоты III стадия – получение H2SO4 3-я стадия

Выводы Серная кислота может являться реагентом для получения водорода Серная кислота является сильным окислителем Серная кислота взаимодействует не только с металлами стоящие в ряду напряжений до водорода, но и со стоящими после него. Хлорид бария может являться качественным реагентом на сульфат-анион Производство серной кислоты является сложным многостадийным химическим процессом

Проверь себя Вариант I Вариант II В 1. А Б 2. Г А 3. А А 4. В В 5. Б

УРОК ОКОНЧЕН