Презентация на тему: Серная кислота 9 класс

Тема урока: «Серная кислота» 9 класс

План урока: Строение молекулы серной кислоты Физические свойства Химические свойства Получение Применение

Строение молекулы серной кислоты H2SO4 - молекулярная формула Вопросы: Простое или сложное вещество? Какова валентность атомов: H, S, O? Какой тип химических связей в веществе? Какой атом более электроотрицательный? К какому атому смещена электронная плотность?

Физические свойства серной кислоты Ответьте на вопросы: Каково агрегатное состояние серной кислоты? Хорошо ли она смешивается с водой? Серная кислота легче, или тяжелее воды? Что произойдет, если прилить воду к кислоте? 5. Какие правила техники безопасности нужно помнить при работе с серной кислотой?

Химические свойства разбавленной кислоты Дописать уравнения реакций: Взаимодействие с металлами: H2SO4+Mg-> Взаимодействие с основными и амфотерными оксидами: H2SO4+Na2O-> Взаимодействие с основаниями: H2SO4+KOH-> Взаимодействие с солями: H2SO4+BaCL2->

Химические свойства концентрированной кислоты: 1.Сильный окислитель. Обугливает органические вещества . С12Н22О11------>12С+11Н2О 2. С водой образует гидраты: H2SO4+nH2O H2SO4*nH2O 3.Регирует почти со всеми металлами: Cu+2H2SO4 CuSO4+SO2+2H2O

Взаимодействие концентрированной серной кислоты с металлами

Соли серной кислоты Предложите названия следующим веществам . Каково их применение?

Получение серной кислоты в промышленности Осуществить цепочку превращения: FeS2 SO2 SO3 H2SO4 По учебнику самостоятельно изучить получение серной кислоты в промышленности. Обсудите полученные знания с соседом по парте. Демонстрация эксперимента получения серной кислоты в лаборатории.
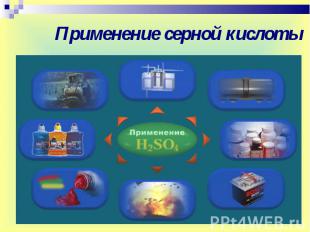
Применение серной кислоты

Домашнее задание: Рудзитис: &13. Гузей: &19.4, упр. 1,2,5-11 устно, Упр. 14-21 письменно.























