Презентация на тему: Презентация Концентрированная серная кислота

Концентрированная серная кислота Учитель: Немухина Н.Р. МБОУ СОШ № 1 г. Королева
«Ни одна наука не нуждается в эксперименте в такой степени, как химия. Ее основные законы, теории и выводы опираются на факты. Поэтому постоянный контроль опытом необходим». «Ни одна наука не нуждается в эксперименте в такой степени, как химия. Ее основные законы, теории и выводы опираются на факты. Поэтому постоянный контроль опытом необходим». М. Фарадей.
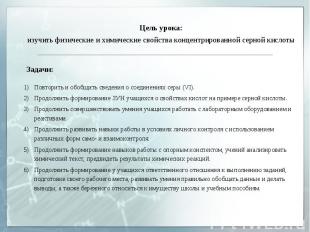
Цель урока: изучить физические и химические свойства концентрированной серной кислоты Повторить и обобщить сведения о соединениях серы (VI). Продолжить формирование ЗУН учащихся о свойствах кислот на примере серной кислоты. Продолжить совершенствовать умения учащихся работать с лабораторным оборудованием и реактивами. Продолжить развивать навыки работы в условиях личного контроля с использованием различных форм само- и взаимоконтроля. Продолжить формирование навыков работы с опорным конспектом, учений анализировать химический текст, предвидеть результаты химических реакций. Продолжить формирование у учащихся ответственного отношения к выполнению заданий, подготовке своего рабочего места, развивать умения правильно обобщать данные и делать выводы, а также бережного относиться к имуществу школы и учебным пособиям.

Техника безопасности Перед началом работы внимательно прочитайте инструкцию по ее выполнению. Проверьте наличие на рабочем месте необходимого оборудования и реактивов. Освободите рабочее место от всех не нужных для работы предметов и материалов. Выполняйте только ту работу, которая предусмотрена заданием учителя. Не отвлекайтесь сами и не отвлекайте других от работы посторонними разговорами. Прежде чем взять реактив, внимательно посмотрите на этикетку. Химические реактивы необходимо брать в количествах, указанных в инструкции. При работе с кислотами обязательно используйте защитные очки. При попадании на руку растворов щелочей или кислот необходимо сразу же промыть поврежденный участок кожи водой. После окончания работы приведите в порядок рабочее место.

Входной контроль На выполнение задания отводится 5 минут. Работайте самостоятельно. Если Вы верно ответили на все 8 вопросов, поставьте 8 баллов, 7 вопросов – 7 баллов, 6 вопросов – 6 баллов, и т.д.

Физические свойства концентрированной серной кислоты H2SO4 – тяжелая маслянистая жидкость, не имеющая цвета, смешивается с водой в любых соотношениях. Растворение – процесс экзотермический. H2SO4 (конц.) + nH2O = H2SO4 · nH2O + Q Поэтому при разбавлении H2SO4 (конц.) кислоту наливают в воду, непрерывно перемешивая.

Физические свойства концентрированной серной кислоты H2SO4 (конц.) активно поглощает воду из воздуха, отнимает ее от других веществ. (C6H10O5)n = 6nC + 5nH2O C12H22O11 = 12C + 11H2O

Физические свойства концентрированной серной кислоты Концентрированная серная кислота обугливает органические вещества – сахар, бумагу, дерево, волокна и т.д. Обугливание сахара можно выразить уравнением: С12Н22O11+n H2SO4(конц.) =12С+ H2SO4· n11Н2О

Химические свойства серной кислоты Вспомните, какие химические свойства характерны для раствора серной кислоты (см. учебник и рабочую тетрадь). Самостоятельно впишите формулы в блок модуля. Время выполнения задания 7-10 минут.

Химические свойства концентрированной серной кислоты Опыт № 1 Реактивы на столах: концентрированная серная кислота. Приготовьте раствор H2SO4. Для этого в пробирку с водой добавьте с помощью пипетки несколько капель концентрированной серной кислоты. Потрогайте пробирку. Напишите уравнение реакции.

Химические свойства концентрированной серной кислоты

Химические свойства концентрированной серной кислоты Опыт № 3 Реактивы на столах: раствор серной кислоты, магниевая и медная стружки. Поместите в одну пробирку с H2SO4 магниевую стружку, в другую пробирку с кислотой поместите медную стружку. Что наблюдаете? Сделайте вывод о взаимодействии раствора серной кислоты с металлами . Составьте уравнения реакций.



Закрепление знаний Ответьте на вопросы: 1). Можно ли при попадании на кожу концентрированной серной кислоты смыть ее водой? Почему? 2). Можно ли с помощью кусочка мела определить, в какой пробирке соляная кислота, а в какой серная? Почему?

Самостоятельная работа Работа выполняется по вариантам. Если Вы сидите ближе к окну, то выполняете первый вариант. Если ближе к двери – второй. Каждый правильный ответ оценивается в 1 балл. После выполнения работы проводится перекрестная самопроверка.

Домашнее задание

Рефлексия Вернитесь к целям урока. Достигли ли Вы их в ходе работы? Возникли ли у Вас трудности при проведении химического эксперимента? Возникли ли у Вас трудности при составлении и написании уравнений реакций? Как Вы считаете, можно ли использовать знания, полученные на уроке, в повседневной жизни? Понравился ли Вам урок? Было ли Вам удобно работать с модульными блоками? При положительном ответе на вопрос поднимите желтую карточку, при отрицательном – зеленую.

Спасибо за внимание