Презентация на тему: Гидролиз

Гидролиз

Содержание урока 1. Понятие :гидролизКлассификация гидролиза2. Гидролиз органических веществ3. Гидролиз солей4. Гидролиз неорганических веществ

Гидролиз – это реакция обменного разложения веществ водой Частицы растворенного вещества в воде окружены гидратной оболочкой. В некоторых случаях это приводит к химическому взаимодействию с образованием новых веществ, к реакции гидролиза hydro – вода, lysis - распад
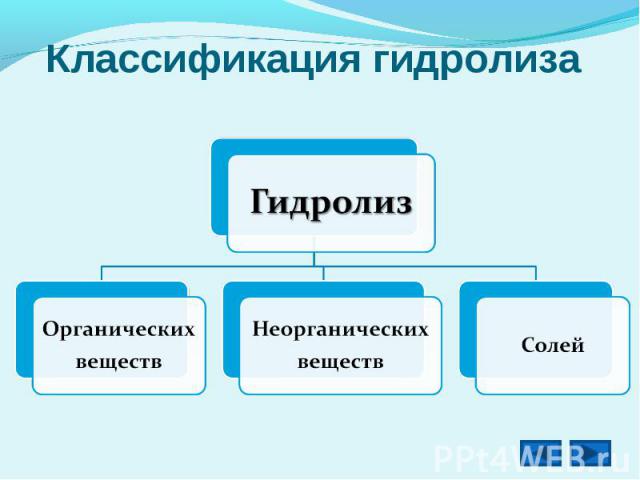
Классификация гидролиза
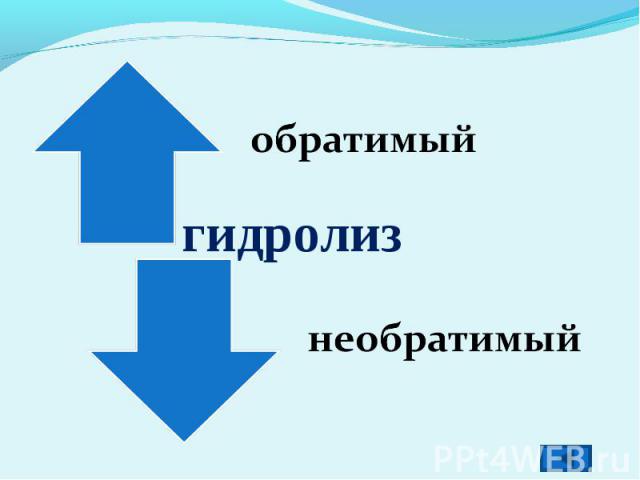
обратимыйгидролизнеобратимый

Гидролиз органических веществ Гидролиз галагеналкановГидролиз сложных эфиров (жиров)Гидролиз углеводовГидролиз белковГидролиз АТФ (аденозинтрифосфорная кислота)

Гидролиз галагеналканов R-Cl + H2O t, OH R-OH + HCl
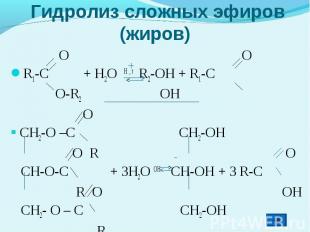
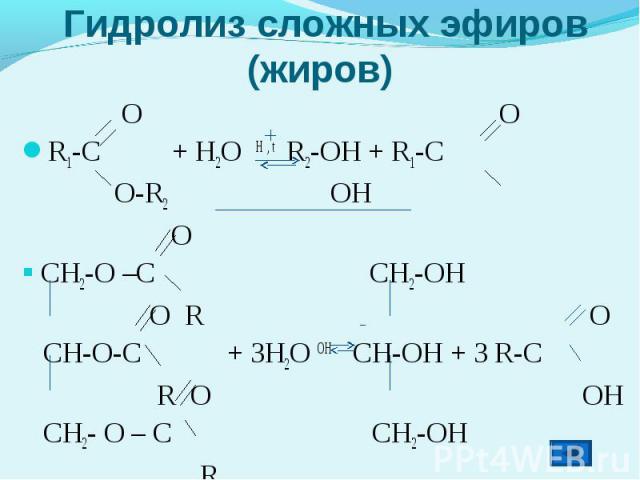
Гидролиз сложных эфиров (жиров) O OR1-C + H2O H , t R2-OH + R1-C O-R2 OH OCH2-O –C CH2-OH O R O CH-O-C + 3H2O OH CH-OH + 3 R-C R O OH CH2- O – C CH2-OH R
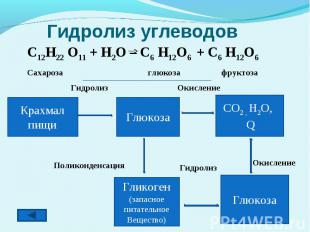
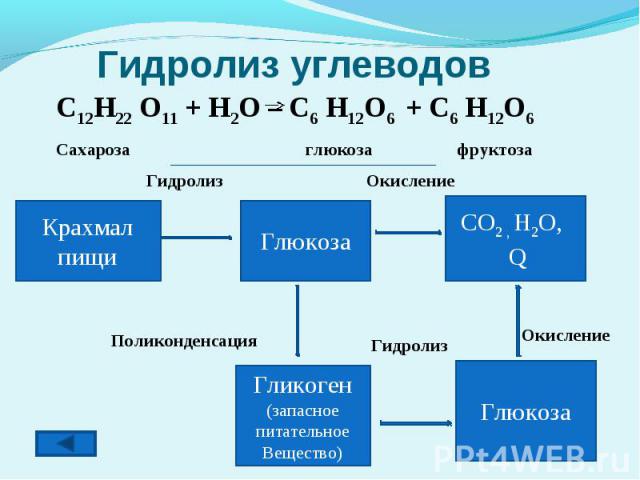
Гидролиз углеводов C12H22 O11 + H2O – C6 H12O6 + C6 H12O6Сахароза глюкоза фруктоза

Гидролиз белков O H O HH2N – CH2 – C – N – CH – C – N – CH – COOH CH2 CH2 OH OH трипептид HO H HO H O O OH2N – CH2 – C + H2N – CH – C + H2N – CH – C OH OH OH CH2 CH2 OH SHаминокислоты

Гидролиз АТФ(аденозинтрифосфорная кислота) АТФ + Н2О Н3РО4 + АДФ + энергия

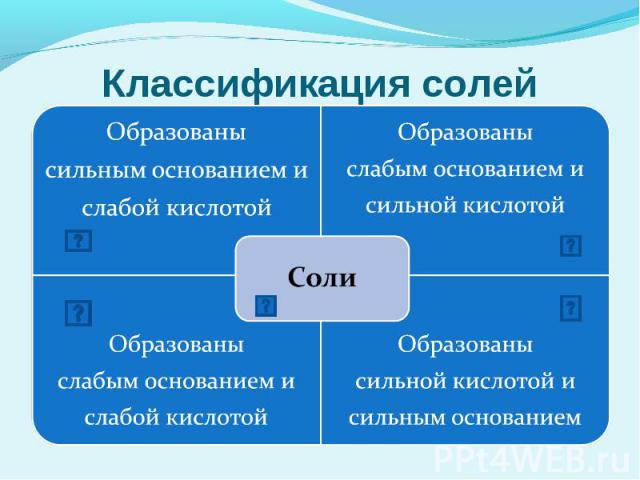
Гидролиз солей Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате образуется слабый электролит.Любая соль – это продукт взаимодействия основания с кислотой. В зависимости от силы основания и кислоты выделяют 4 типа солей.
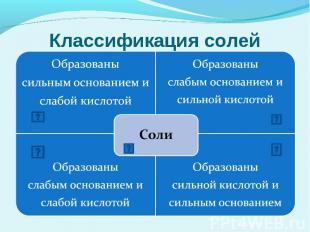
Классификация солей

Слабые кислоты:HCOOH, CH3COOH, HCN, H2S, HF,H2CO3, H2 SO3, H3PO4 , HNO2 ;Слабые основания:основания (за исключением щелочей), NH4 OH
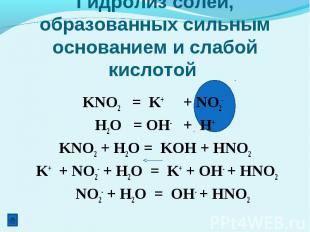
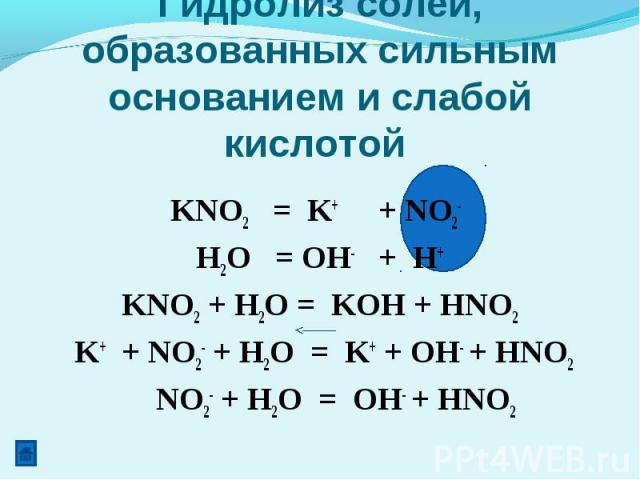
Гидролиз солей, образованных сильным основанием и слабой кислотой KNO2 = K+ + NO2- H2O = OH- + H+KNO2 + H2O = KOH + HNO2 K+ + NO2- + H2O = K+ + OH- + HNO2 NO2- + H2O = OH- + HNO2

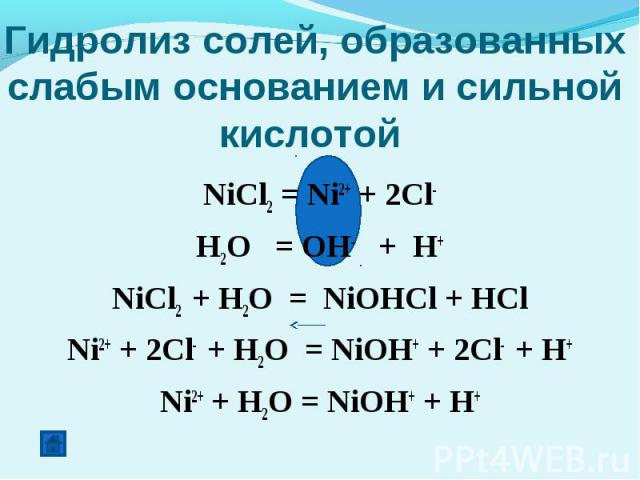
Гидролиз солей, образованных слабым основанием и сильной кислотой NiCl2 = Ni2+ + 2Cl-H2O = OH- + H+NiCl2 + H2O = NiOHCl + HClNi2+ + 2Cl- + H2O = NiOH+ + 2Cl- + H+Ni2+ + H2O = NiOH+ + H+
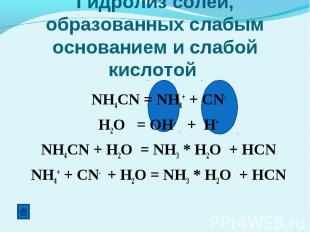
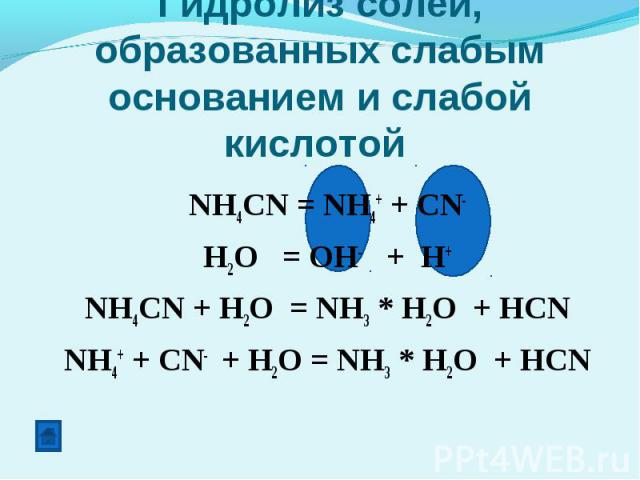
Гидролиз солей, образованных слабым основанием и слабой кислотой NH4CN = NH4+ + CN-H2O = OH- + H+NH4CN + H2O = NH3 * H2O + HCNNH4+ + CN- + H2O = NH3 * H2O + HCN

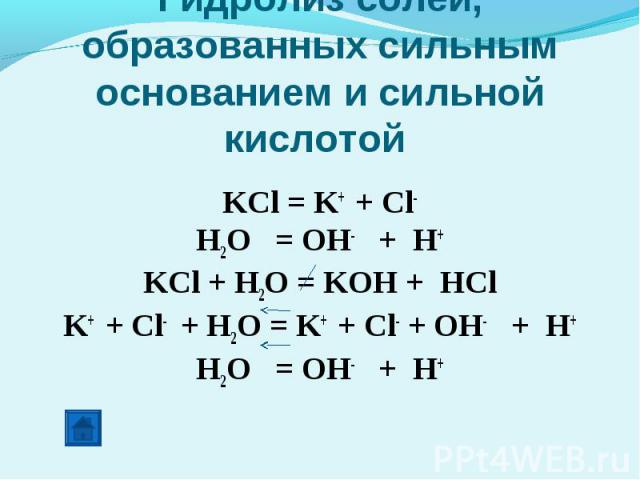
Гидролиз солей, образованных сильным основанием и сильной кислотой KCl = K+ + Cl-H2O = OH- + H+KCl + H2O = KOH + HClK+ + Cl- + H2O = K+ + Cl- + OH- + H+H2O = OH- + H+

Гидролиз солей

Гидролиз неорганических соединений Полному и необратимому гидролизу в водном растворе подвергаются некоторые бинарные соединения:карбиды;галогениды;фосфиды;нитриды

Гидролиз карбидов CaC2 + 2H2O = Ca(OH)2 +C2 H2Карбид кальция ацетиленAl4C3 + 12 H2O = 4 Al(OH)3 + 3 CH4Карбид алюминия метан

Гидролиз галогенидов SiCl4 + 3H2O = H2SiO4 + 4 HСl Хлорид Кремневая кремния кислотаГидролиз фосфидовMg3P2 + 6 H2O = 3Mg(OH)2 + 2PH3 Фосфид магния