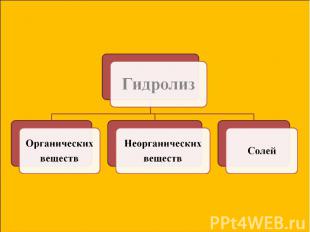
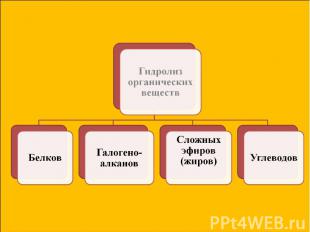
Презентация на тему: Гидролиз

Частицы растворенного вещества в воде окружены гидратной оболочкой. В некоторых случаях это приводит к химическому взаимодействию с образованием новых веществ, к реакции гидролиза. Частицы растворенного вещества в воде окружены гидратной оболочкой. В некоторых случаях это приводит к химическому взаимодействию с образованием новых веществ, к реакции гидролиза. hydro – вода, lysis - распад
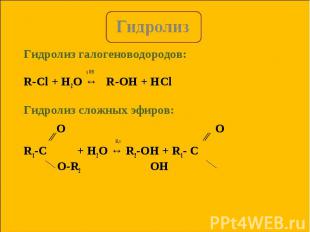
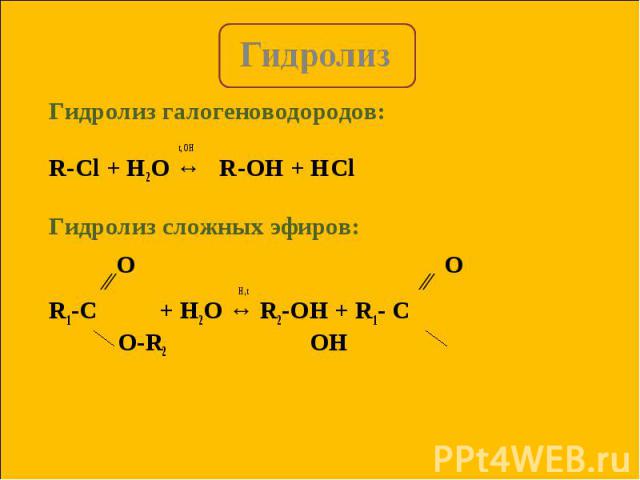
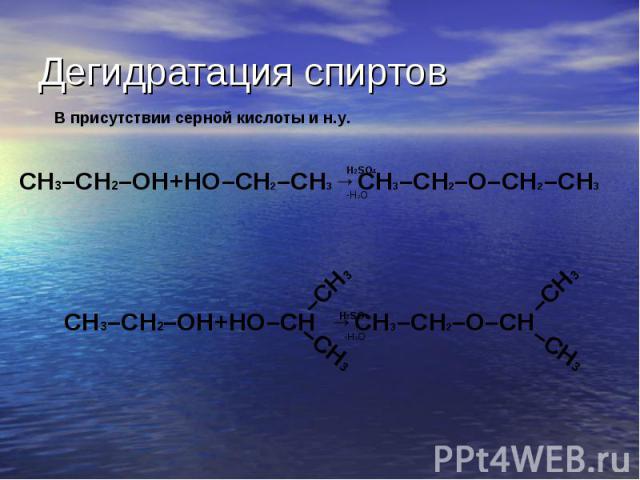
Гидролиз галогеноводородов: Гидролиз галогеноводородов: t, OH R-Cl + H2O ↔ R-OH + HCl Гидролиз сложных эфиров: ∕∕ H , t ∕∕ R1-C + H2O ↔ R2-OH + R1- C O-R2 OH

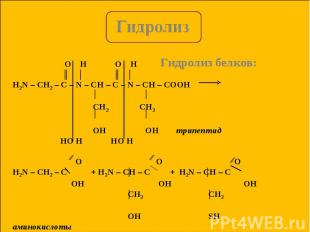

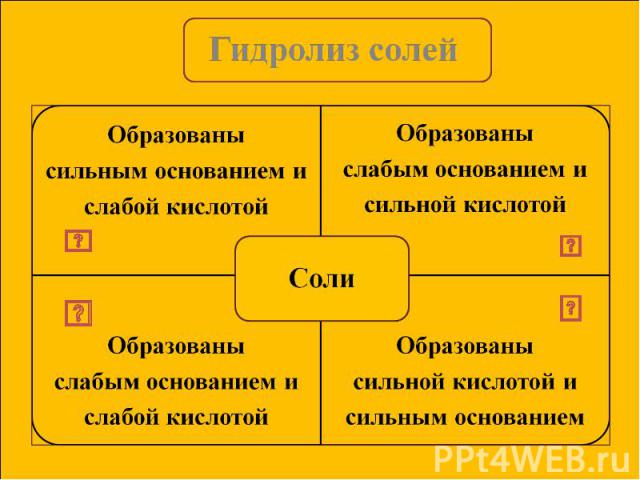
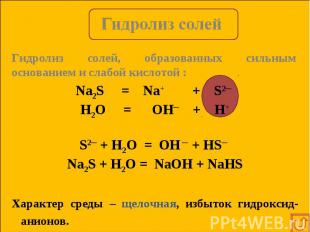
Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате образуется слабый электролит. Сущность гидролиза сводится к обменному химическому взаимодействию катионов или анионов соли с молекулами воды. В результате образуется слабый электролит. Любая соль – это продукт взаимодействия основания с кислотой. В зависимости от силы основания и кислоты выделяют 4 типа солей.
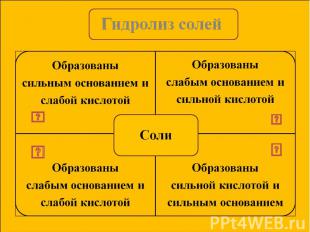
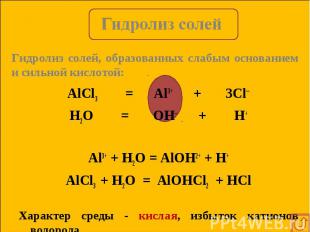
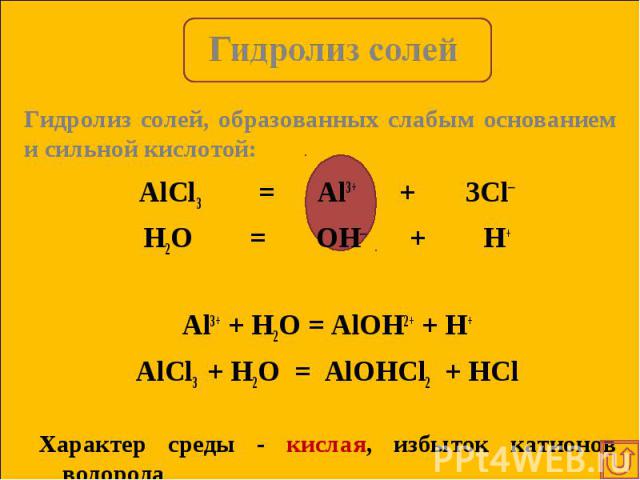
AlCl3 = Al3+ + 3Cl─ AlCl3 = Al3+ + 3Cl─ H2O = OH─ + H+ Al3+ + H2O = AlOH2+ + H+ AlCl3 + H2O = AlOHCl2 + HCl Характер среды - кислая, избыток катионов водорода

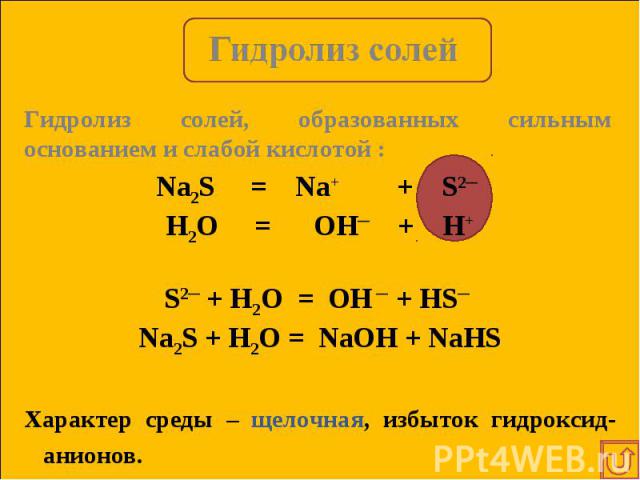
NH4CN = NH4+ + CN─ NH4CN = NH4+ + CN─ H2O = OH─ + H+ NH4+ + CN- + H2O = NH3 ● H2O + HCN NH4CN + H2O = NH3 ● H2O + HCN Характер среды зависит от силы образовавшегося слабого электролита.


KCl = K+ + Cl- KCl = K+ + Cl- Слабых ионов нет, гидролиз не идет, среда нейтральная.


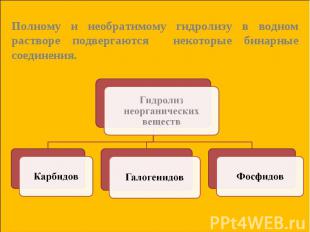

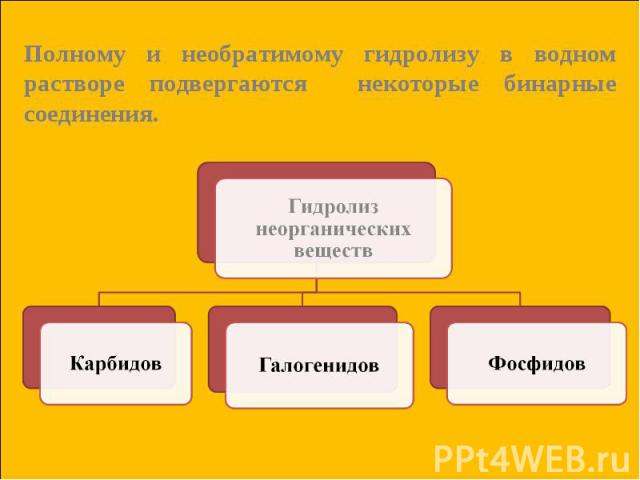
Гидролиз карбидов: Гидролиз карбидов: CaC2 + 2H2O = Ca(OH)2 + C2 H2↑ Карбид ацетилен кальция Al4C3 + 12H2O = 4Al(OH)3 + 3CH4↑ Карбид метан алюминия

Гидролиз галогенидов: Гидролиз галогенидов: SiCl4 + 3H2O = H2SiO4↓ + 4HСl хлорид кремниевая кремния (+4) кислота Гидролиз фосфидов: Са3P2 + 6H2O = 3Са(OH)2 + 2PH3↑ фосфид фосфин кальция