Презентация на тему: Гидролиз солей

Тема урока: «Гидролиз солей» Новикова Ирина Петровна учитель химии МОУ Совхозная сош Тамбовский район

Изменение цвета различных индикаторов при действии растворов кислот и щелочей

Таблица 1

Таблица 1

Таблица 1

Таблица 1

Таблица 1

Таблица 1

Упрощенная схема гидролиза AlCl3

Соль, образованная слабым основанием и сильной кислотой, имеет кислую среду, так как в растворе избыток ионов водорода.
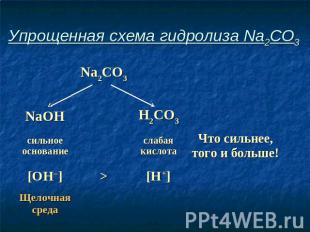
Упрощенная схема гидролиза Na2CO3

Соль, образованная сильным основанием и слабой кислотой, имеет щелочную среду, так как в растворе избыток гидроксид-ионов.
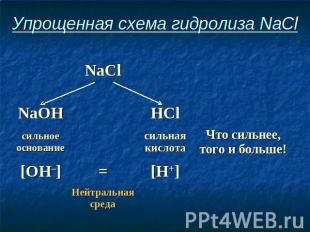
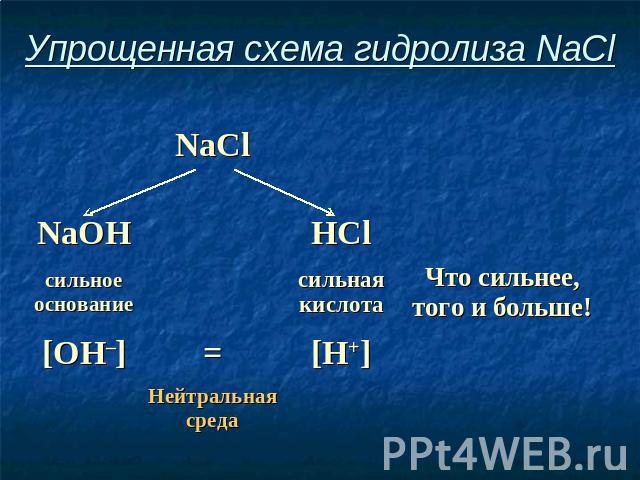
Упрощенная схема гидролиза NaCl

Соль, образованная сильным основанием и сильной кислотой, имеет нейтральную среду, так как в растворе одинаковое количество ионов водорода и гидроксид-ионов.

Гидролиз — это реакция обмена между некоторыми солями и водой («гидро» — вода, «лизис» — разложение)

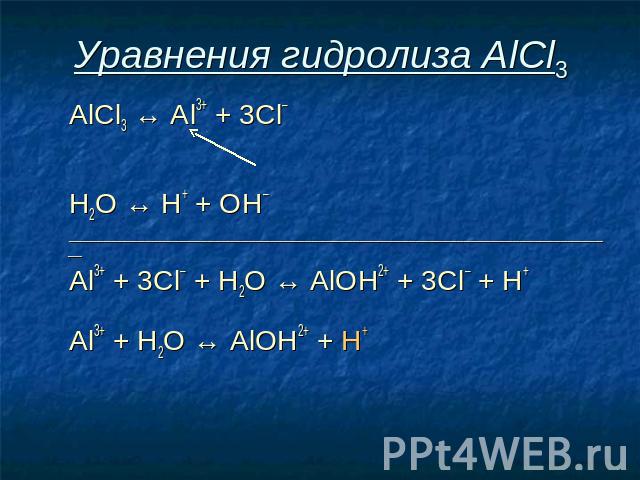
Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl–

Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН–

Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– _______________________________________________________________________________

Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– _______________________________________________________________________________ Al3+ + 3Сl– + Н2O ↔ АlOН2+ + 3Сl– + Н+
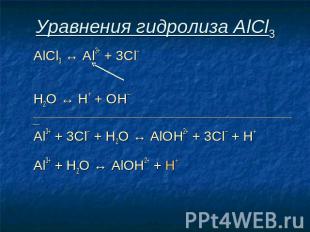
Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– _______________________________________________________________________________ Al3+ + 3Сl– + Н2O ↔ АlOН2+ + 3Сl– + Н+ Аl3+ + Н2O ↔ АlOН2+ + Н+

Уравнения гидролиза АlСl3 АlСl3 ↔ Аl3+ + 3Сl– Н2O ↔ Н+ + ОН– ___________________________________________________________________ Al3+ + 3Сl– + Н2O ↔ АlOН2+ + 3Сl– + Н+ Аl3+ + Н2O ↔ АlOН2+ + Н+ Избыток ионов водорода дает соли кислую среду, поэтому лакмус краснеет.

Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32–

Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН–

Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________

Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ 2Na+ + СO32– + Н2O ↔ 2Na+ + HCO3– + ОН–

Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ 2Na+ + СO32– + Н2O ↔ 2Na+ + HCO3– + ОН– СO32– + Н2O ↔ НСO3– + ОН–

Уравнения гидролиза Na2CO3 Na2CO3 ↔ 2Na+ + СO32– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ 2Na+ + СO32– + Н2O ↔ 2Na+ + HCO3– + ОН– СO32– + Н2O ↔ НСO3– + ОН– Избыток гидроксид-ионов дает соли щелочную среду, поэтому лакмус синеет, а фенолфталеин становится малиновым.

Уравнения гидролиза NaCl NaCl ↔ Na+ + Сl– Н2O ↔ Н+ + ОН– ____________________________________________________________________________ Na+ + Сl– + Н2O ↔ Na+ + Cl– + H2O Одинаковое количество гидроксид-ионов и ионов водорода дает соли нейтральную среду, поэтому индикаторы не меняют окраску (гидролизу не подвергается).

Какую среду будут иметь водные растворы следующих солей: 1 вариант 2 вариант а) нитрата цинка (II) а) хлорида меди (II) б) сульфата калия б) сульфита натрия в) сульфида натрия в) нитрата бария Составьте ионное уравнение гидролиза этих солей.

Ответы

а) 1 вариант Zn(NO3)2 ↔ Zn2+ + 2NO3– Н2O ↔ Н+ + ОН – ________________________________________________________ Zn2+ + 2NO3– + Н2O ↔ ZnOН+ + 2NO3– + Н+ Zn2+ + Н2O ↔ ZnOН+ + Н+ (среда кислая) 2 вариант CuCl2 ↔ Cu2+ + 2Сl – Н2O ↔ Н+ + ОН – _______________________________________________________________________________________________________________________ Cu2+ + Сl – + Н2O ↔ CuOH+ + Cl – + Н+ Сu2+ + Н2O ↔ СuOH+ + Н+ (среда кислая)

б) 1 вариант K2SO4 ↔ 2K+ + SO42– Н2O ↔ Н+ + ОН – ____________________________________________________________________________ 2K+ + SO42– + Н2O ↔ 2K+ + SO42– + H2O (среда нейтральная) 2 вариант Na2SO3 ↔ 2Na+ + SO32– Н2O ↔ Н+ + ОН – ____________________________________________________________________________ 2Na+ + SO32– + Н2O ↔ 2Na+ + HSO3– + ОН SO32– + Н2O ↔ НSO3– + ОН – (среда щелочная)

в) 1 вариант Na2S ↔ 2Na+ + S2– Н2O ↔ Н+ + ОН – ____________________________________________________________________________ 2Na+ + S2– + Н2O ↔ 2Na+ + HS– + ОН – S2– + Н2O ↔ НS– + ОН – (среда щелочная) 2 вариант Ba(NO3)2 ↔ Ba2+ + 2NO3– Н2O ↔ Н+ + ОН – ___________________________________________________________________ Ba2+ + 2NO3– + Н2O ↔ Ba2+ + 2NO3– + Н2O (среда нейтральная)

О значении и применении гидролиза... Под действием биологических катализаторов — ферментов в организме человека происходит гидролиз крахмала, целлюлозы, белка, жиров. В технике крахмал подвергают гидролизу при взаимодействии с разбавленной серной кислотой и превращают в глюкозу (это реакция Кирхгофа, 1811 г.). Продукты гидролиза крахмала широко используются в кондитерской промышленности, медицине, для технических целей. В промышленности гидролизу подвергаются сложные эфиры и жиры обязательно в щелочной среде. Такая реакция называется омылением. На этой реакции основано производство мыла, однако в настоящее время на производство моющих средств идут главным образом продукты переработки нефти. Продукты гидролиза целлюлозы в промышленности — это бумага, хлопчатобумажные ткани.

Домашнее задание. Пользуясь таблицей «Сильные и слабые электролиты», приведите свои примеры солей, которые будут иметь кислую, щелочную и нейтральную среду раствора, и напишите к ним ионные уравнения гидролиза.

Урок окончен

Источники материалов Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. — М.: Экзамен, 2001. Хомченко Г.П. , Хомченко И.Г. Сборник задач по химии. — М., 2000 . http://hydorlysis.narod.ru/pages/teoria.htm http://www.xumuk.ru/encyklopedia/1047.html