Презентация на тему: ГИДРОЛИЗ СОЛЕЙ.



Цель: изучить сущность гидролиза солей в водных Цель: изучить сущность гидролиза солей в водных растворах. Задачи : сформулировать определение понятия «гидролиз» научиться объяснять химические процессы, протекающие в водных растворах солей записывать уравнения реакций гидролиза предсказывать и объяснять изменение кислотности среды и образование кислых и основных солей в этом процессе познакомиться с ролью гидролиза солей в природе, хозяйственной деятельности и повседневной жизни человека.

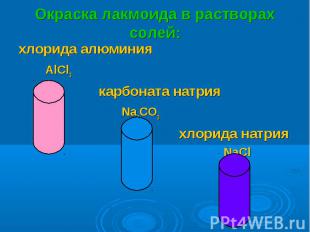
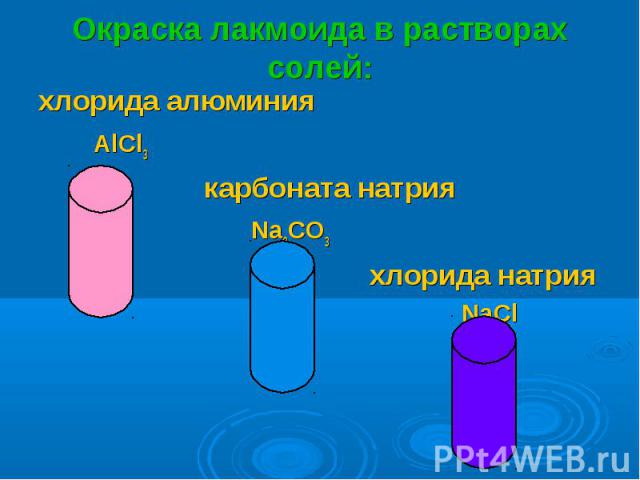
хлорида алюминия хлорида алюминия AlCl3 карбоната натрия Na2CO3 хлорида натрия NaCl

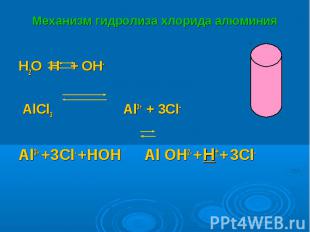
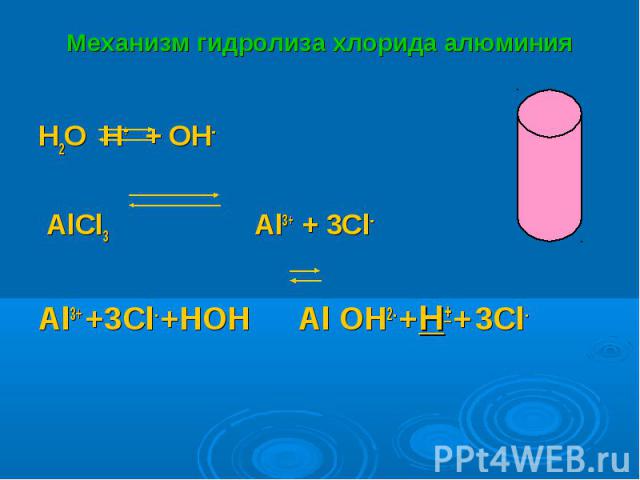
H2O H+ + OH- H2O H+ + OH- AlCl3 Al3+ + 3Cl- Al3+ +3Cl- +HOH Al OH2- +H+ + 3Cl-
![AlCl3 AlCl3 Al(OH)3 HCl слабое основание сильная кислота [OH]- < [H]+ (что си AlCl3 AlCl3 Al(OH)3 HCl слабое основание сильная кислота [OH]- < [H]+ (что си](https://fs1.ppt4web.ru/images/95369/132721/310/img8.jpg)
AlCl3 AlCl3 Al(OH)3 HCl слабое основание сильная кислота [OH]- < [H]+ (что сильней того и больше!) К и с л о т н а я среда

Определить состав соли, то есть указать, каким по силе основанием и какой по силе кислотой образована данная соль. Определить состав соли, то есть указать, каким по силе основанием и какой по силе кислотой образована данная соль. Взять ион слабого электролита и написать уравнение взаимодействия его с составными частями одной молекулы воды; в результате получить краткое ионное уравнение гидролиза. Написать на основании краткого ионного уравнения молекулярное уравнение. Исходные вещества известны – соль и вода. Продукты гидролиза составить, связывая образовавшиеся ионы с теми ионами соли, которые не участвуют в реакции гидролиза.

Сформулируем вывод: Сформулируем вывод: Раствор соли, образованной ________________, имеет _____________реакцию, так как в растворе избыток___________________.

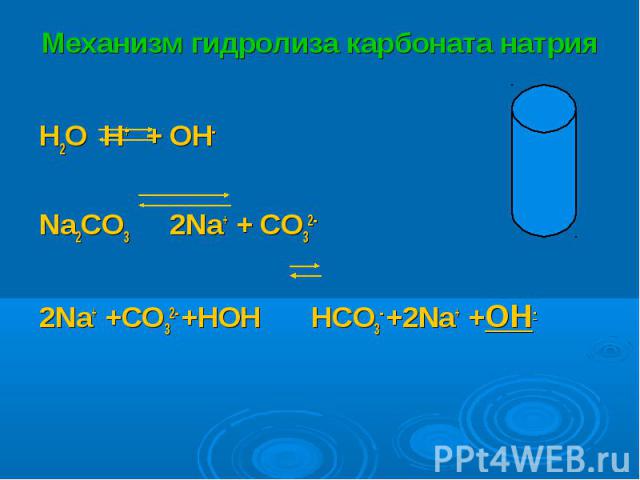
H2O H+ + OH- H2O H+ + OH- Na2CO3 2Na+ + CO32- 2Na+ +CO32- +HOH HCO3- +2Na+ +OH-
![Na2CO3 Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]- > [H]+ (что с Na2CO3 Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]- > [H]+ (что с](https://fs1.ppt4web.ru/images/95369/132721/310/img12.jpg)
Na2CO3 Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]- > [H]+ (что сильней того и больше!) Щ е л о ч н а я среда

Определить состав соли, то есть указать, каким по силе основанием и какой по силе кислотой образована данная соль. Определить состав соли, то есть указать, каким по силе основанием и какой по силе кислотой образована данная соль. Взять ион слабого электролита и написать уравнение взаимодействия его с составными частями одной молекулы воды; в результате получить краткое ионное уравнение гидролиза. Написать на основании краткого ионного уравнения молекулярное уравнение. Исходные вещества известны – соль и вода. Продукты гидролиза составить, связывая образовавшиеся ионы с теми ионами соли, которые не участвуют в реакции гидролиза.

Сформулируем вывод: Сформулируем вывод: Раствор соли, образованной ________________, имеет__________реакцию, так как в растворе избыток ________________.
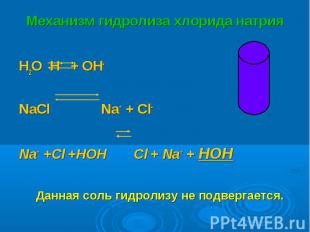
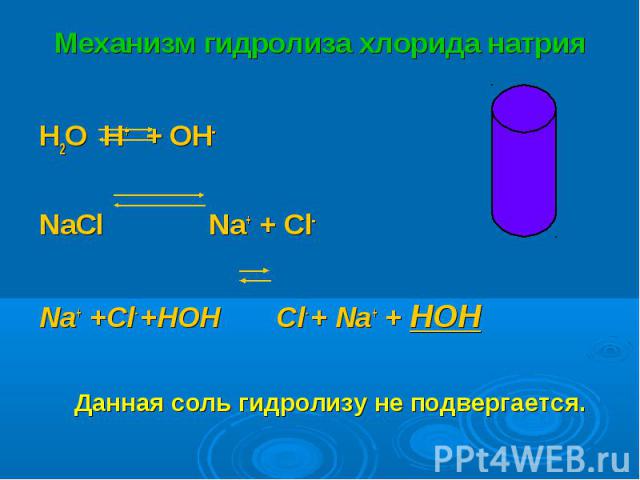
H2O H+ + OH- H2O H+ + OH- NaСl Na+ + Cl- Na+ +Cl- +HOH Cl- + Na+ + HOH Данная соль гидролизу не подвергается.
![NaCl NaCl NaOH HCl сильное основание сильная кислота [OH]- = [H]+ Н е й т р а л NaCl NaCl NaOH HCl сильное основание сильная кислота [OH]- = [H]+ Н е й т р а л](https://fs1.ppt4web.ru/images/95369/132721/310/img16.jpg)
NaCl NaCl NaOH HCl сильное основание сильная кислота [OH]- = [H]+ Н е й т р а л ь н а я среда

Сформулируем вывод: Сформулируем вывод: Раствор соли, образованной__________________, имеет________________________реакцию, так как в растворе__________________________________.

К какому типу мы отнесем данные реакции? К какому типу мы отнесем данные реакции? Какие вещества в них участвуют? В чем заключается сущность гидролиза? Какие продукты данных взаимодействий с точки зрения теории электролитической диссоциации мы получили

ГИДРОЛИЗ – это реакция обмена между некоторыми солями и водой приводящая к образованию слабого электролита.


Преобразование земной коры Преобразование земной коры Обеспечение слабощелочной среды морской воды

Порча производственного оборудования Порча производственного оборудования Выработка из непищевого сырья ценных продуктов (бумага, мыло, спирт, глюкоза, белковые дрожжи) Очистка промышленных стоков и питьевой воды (сульфат алюминия + вода гидроксид алюминия) Подготовка тканей к окрашиванию Известкование почв основано на гидролизе

Стирка Стирка Мытье посуды Умывание с мылом Процессы пищеварения






![AlCl3 AlCl3 Al(OH)3 HCl слабое основание сильная кислота [OH]- < [H]+ (что сильней того и больше!) К и с л о т н а я среда AlCl3 AlCl3 Al(OH)3 HCl слабое основание сильная кислота [OH]- < [H]+ (что сильней того и больше!) К и с л о т н а я среда](https://fs1.ppt4web.ru/images/95369/132721/640/img8.jpg)


![Na2CO3 Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]- > [H]+ (что сильней того и больше!) Щ е л о ч н а я среда Na2CO3 Na2CO3 NaOH H2CO3 сильное основание слабая кислота [OH]- > [H]+ (что сильней того и больше!) Щ е л о ч н а я среда](https://fs1.ppt4web.ru/images/95369/132721/640/img12.jpg)


![NaCl NaCl NaOH HCl сильное основание сильная кислота [OH]- = [H]+ Н е й т р а л ь н а я среда NaCl NaCl NaOH HCl сильное основание сильная кислота [OH]- = [H]+ Н е й т р а л ь н а я среда](https://fs1.ppt4web.ru/images/95369/132721/640/img16.jpg)