Презентация на тему: Гидролиз солей

Гидролиз солей
Попова Светлана Анатольевна Учитель химииГБОУ СОШ №1465 им . Н.Г.Кузнецова
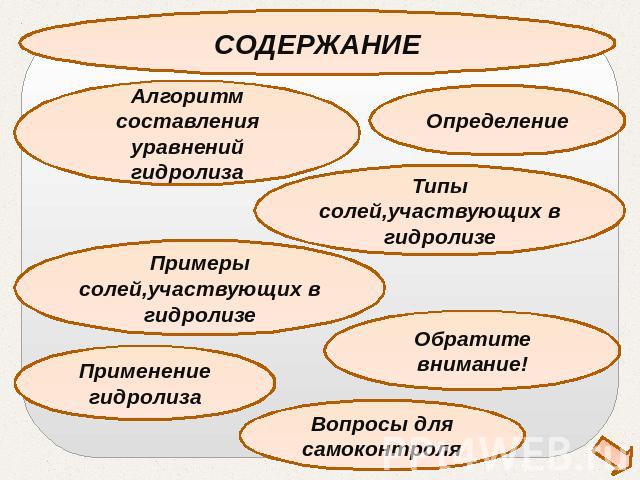
СОДЕРЖАНИЕАлгоритм составления уравнений гидролизаОпределениеТипы солей,участвующих в гидролизеПримеры солей,участвующих в гидролизе
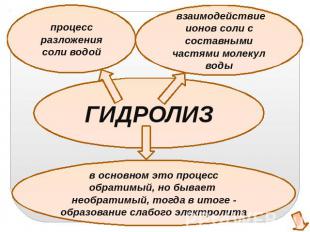
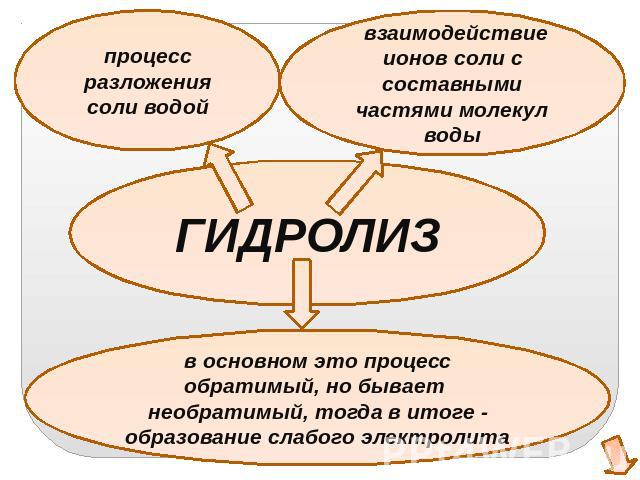
процесс разложения соли водойвзаимодействие ионов соли с составными частями молекул водыГИДРОЛИЗв основном это процесс обратимый, но бывает необратимый, тогда в итоге - образование слабого электролита

Четыре типа солей, участвующих в гидролизе:Соль образована сильным основанием и слабой кислотойСоль образована слабым основанием и сильной кислотойСоль образована слабым основанием и слабой кислотойСоль образована сильным основанием и сильной кислотой

Алгоритм составления уравнений гидролизаПроверить растворимость соли.Определить состав соли, т.е. указать, каким по силе основанием и какой по силе кислотой образована данная соль Записать диссоциацию соли и подчеркнуть ион слабого электролита
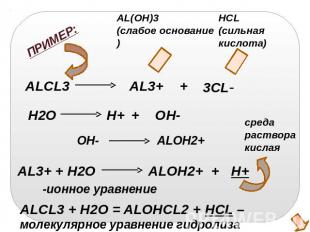
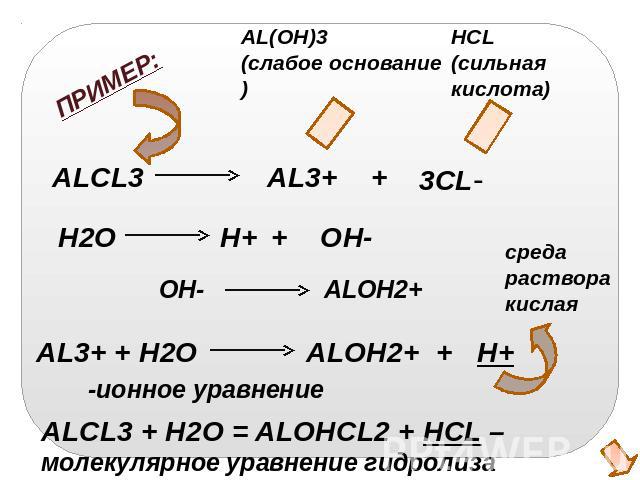
ALCL3 + H2O = ALOHCL2 + HCL – молекулярное уравнение гидролиза

О Б Р А Т И Т Е В Н И М А Н И Е:
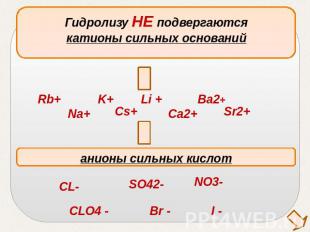
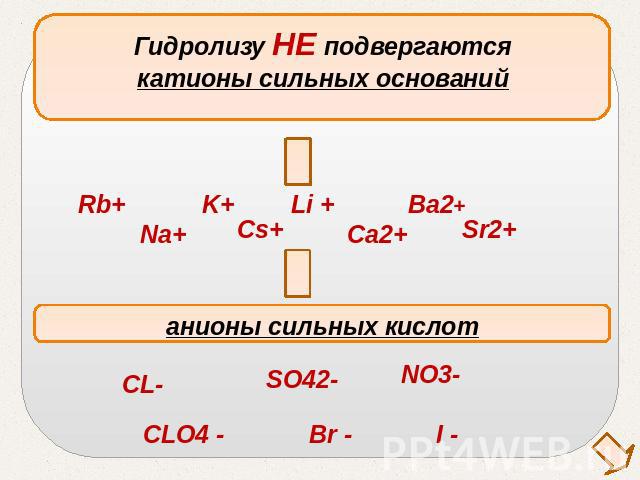
Гидролизу НЕ подвергаютсякатионы сильных основанийанионы сильных кислот
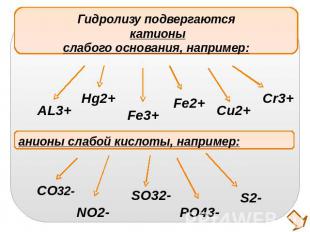
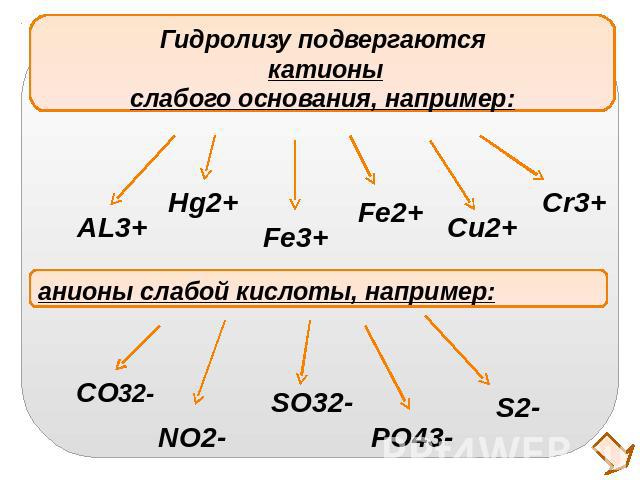
Гидролизу подвергаются катионыслабого основания, например:анионы слабой кислоты, например:
П Р И М Е Р Ы С О Л Е Й,П О Д В Е Р Г А Ю Щ И Х С Я Г И Д Р О Л И З У
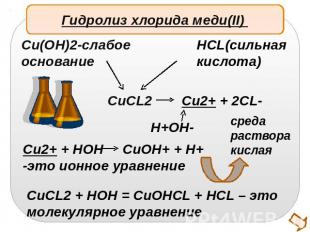
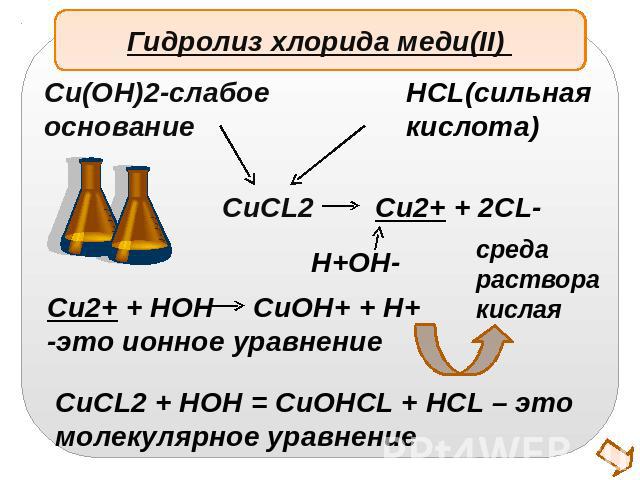
Гидролиз хлорида меди(II) Cu(OH)2-слабоеоснованиеHCL(сильнаякислота)Cu2+ + HOH CuOH+ + H+-это ионное уравнениеCuCL2 + HOH = CuOHCL + HCL – этомолекулярное уравнение
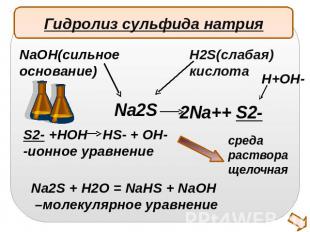
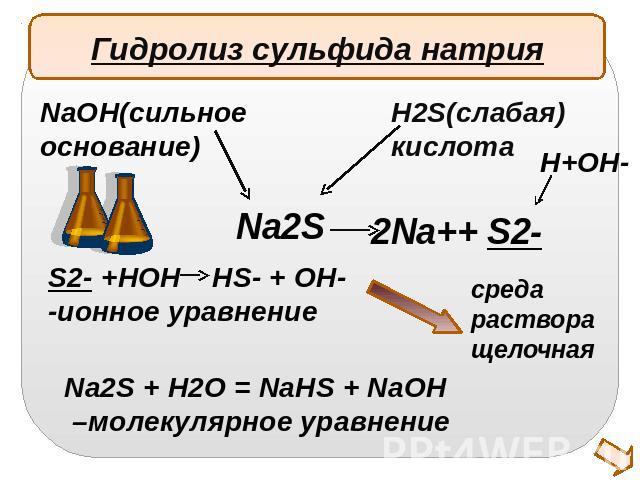
Гидролиз сульфида натрияNaOH(сильноеоснование)H2S(слабая)кислотаS2- +HOH HS- + OH- -ионное уравнениеNa2S + H2O = NaHS + NaOH –молекулярное уравнение
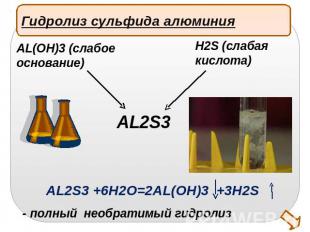
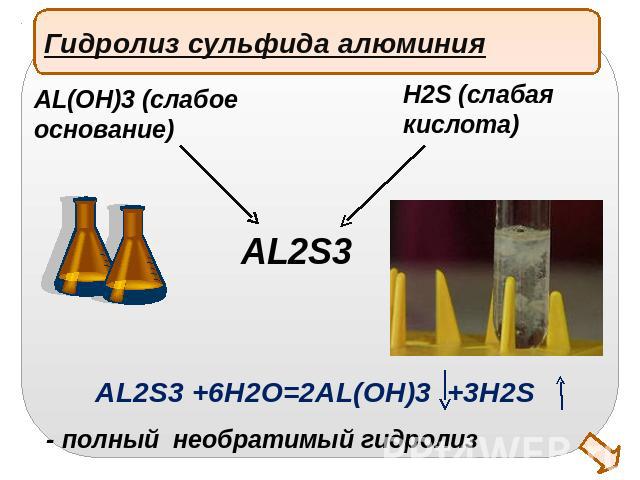
Гидролиз сульфида алюминияAL(OH)3 (слабое основание)H2S (слабаякислота)AL2S3 +6H2O=2AL(OH)3 +3H2S- полный необратимый гидролиз
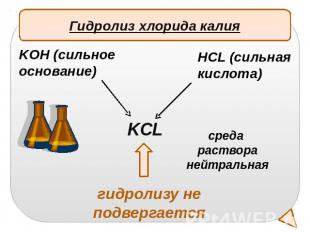
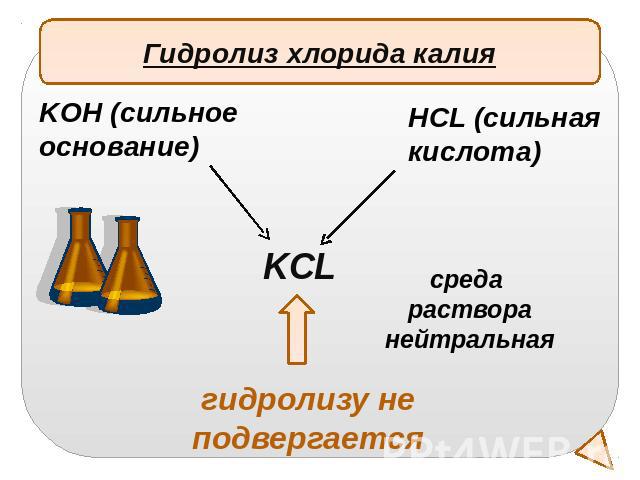
Гидролиз хлорида калияKOH (сильное основание)HCL (сильная кислота)среда растворанейтральнаягидролизу не подвергается
Роль гидролиза в повседневной жизни человекаумываниес мылом

Загрязнения представляют собой смесь твердых частиц (пыли, сажи, соли, жировых, а также потовых пленок, прилипших к поверхности тканей и других предметов). Чтобы удалить загрязнения необходимо: отделить загрязнение от очищаемой поверхности; перевести грязевые частицы в моющий раствор;удержать их в моющем растворе и устранить возможность повторного осаждения на очищаемую поверхность.
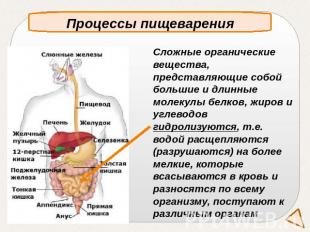
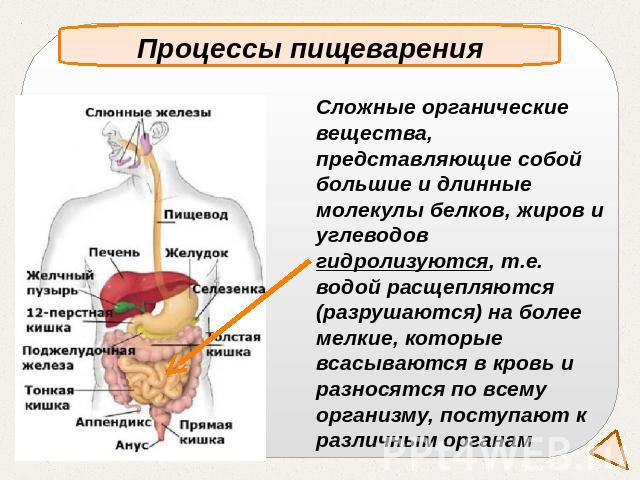
Процессы пищеваренияСложные органические вещества, представляющие собой большие и длинные молекулы белков, жиров и углеводов гидролизуются, т.е. водой расщепляются (разрушаются) на более мелкие, которые всасываются в кровь и разносятся по всему организму, поступают к различным органам

А ТЕПЕРЬ ВОПРОСЫ….

Найди верный ответНейтральную среду имеет водный раствор: 1)нитрита натрия2)силиката калия3)хлорида железа (II)4)нитрата калия

Найди верный ответВ водном растворе какой соли фенолфталеин окрашен в малиновый цвет? 1)CaCl22)KNO33)FeSO44)Na2CO3

Найди верный ответОдинаковую реакцию среды имеют растворы карбоната натрия и 1) нитрата натрия2) силиката натрия3) сульфата калия4) хлорида алюминия
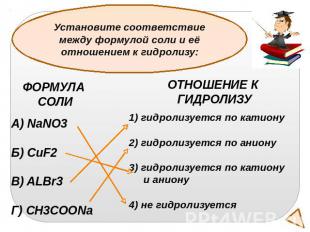
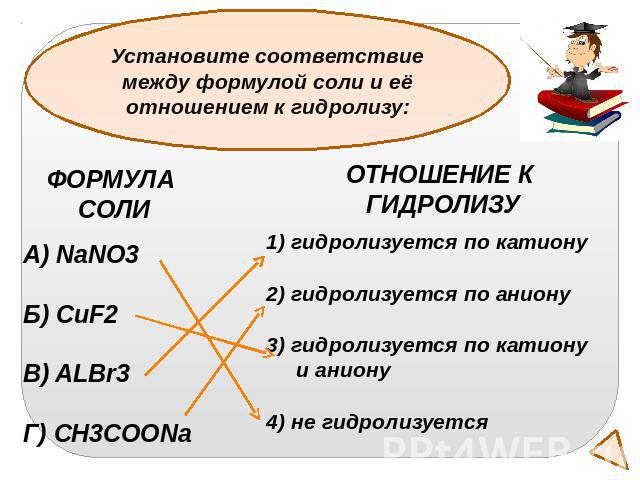
Установите соответствие между формулой соли и её отношением к гидролизу:ФОРМУЛА СОЛИNaNO3Б) CuF2В) ALBr3Г) CH3COONaОТНОШЕНИЕ К ГИДРОЛИЗУгидролизуется по катиону2) гидролизуется по аниону3) гидролизуется по катиону и аниону4) не гидролизуется
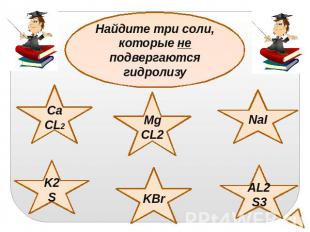
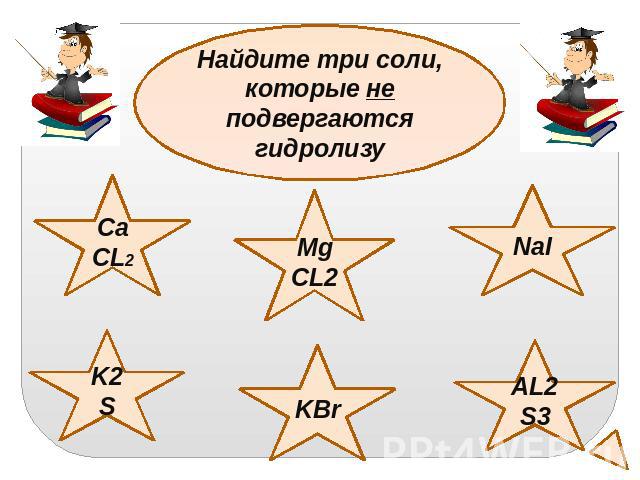
Найдите три соли, которые не подвергаютсягидролизу

Выберите истинные и ложные утвержденияГидролиз нитрата алюминия идет по катионуГидролиз сульфата бария идет по анионуГидролиз щелочей не возможенОксиды подвергаются гидролизуХлорид бария не подвергается гидролизуВ растворе сульфата меди(ll) кислая среда
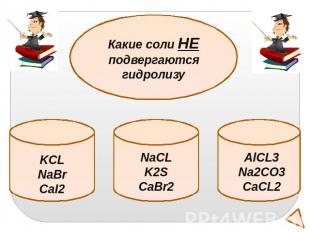
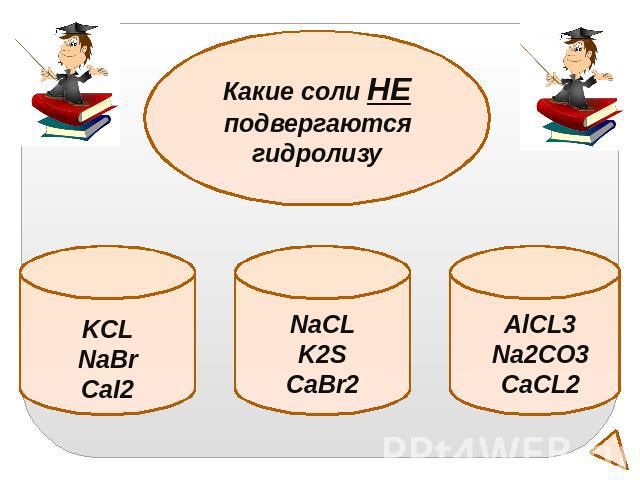
Какие соли НЕ подвергаются гидролизуKCLNaBrCaI2NaCLK2SCaBr2AlCL3Na2CO3CaCL2
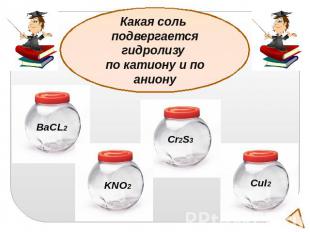
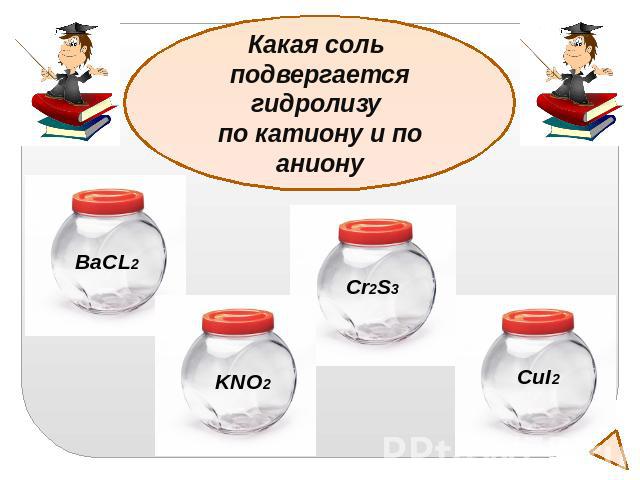
Какая соль подвергается гидролизу по катиону и по аниону
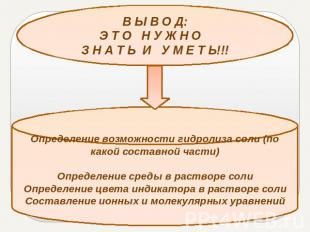
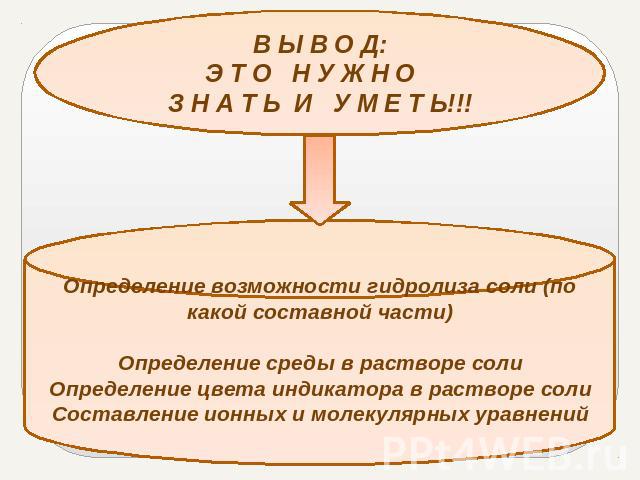
В Ы В О Д:Э Т О Н У Ж Н О З Н А Т Ь И У М Е Т Ь!!!Определение возможности гидролиза соли (по какой составной части)Определение среды в растворе солиОпределение цвета индикатора в растворе солиСоставление ионных и молекулярных уравнений

ССЫЛКИ НА ИСТОЧНИКИ ИНФОРМАЦИИ И ИЗОБРАЖЕНИЙ: