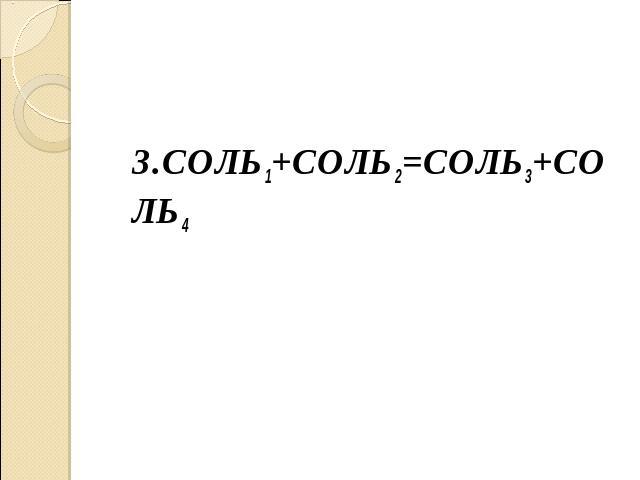Презентация на тему: Химические свойства солей

Домашнее задание §41 упр. 2 стр.225

Кто хочет съесть ядро ореха, должен расколоть его скорлупу плавт
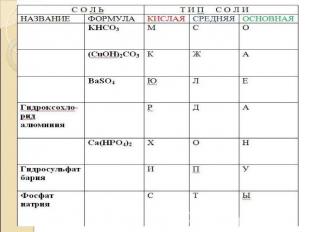

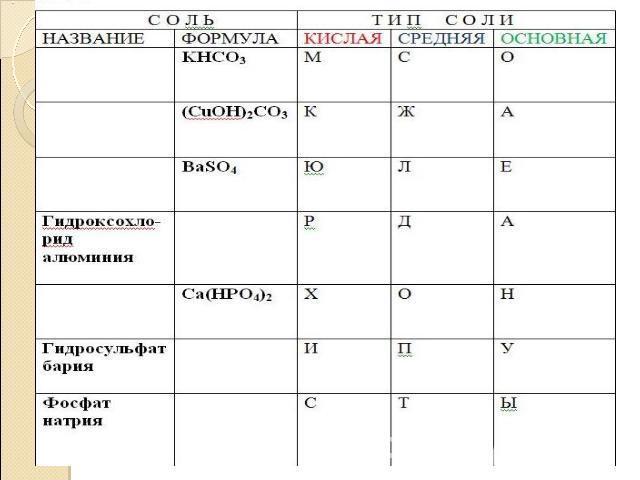
Вычеркните «лишние» формулы и допишите предложения. А) H2SO4 , HNO3, H3PO4, HCl, H2 S – это кислоты, которые не образуют кислых солей, так как ………………………………………………………………………………................

Б) Ca(OH)2, NaOH, Cu(OH)2 , KOH, Fe(OH)2 – это основания, которые не образуют основных солей, так как………………………………………………………………………………………...


ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ

ТИПИЧНЫЕ РЕАКЦИИ СОЛЕЙ СОЛЬ+ КИСЛОТА= ДРУГАЯ СОЛЬ+ ДРУГАЯ КИСЛОТА

2.СОЛЬ+ ЩЕЛОЧЬ= ДРУГАЯ СОЛЬ+ДРУГОЕ ОСНОВАНИЕ
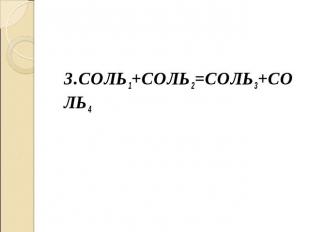
3.СОЛЬ1+СОЛЬ2=СОЛЬ3+СОЛЬ4


4.СОЛЬ+ МЕТАЛЛ= ДРУГАЯ СОЛЬ+ ДРУГОЙ МЕТАЛЛ

эксперимент Железо + сульфат меди(II)=Железо + хлорид бария =

Н.Н БЕКЕТОВ В 1865г ИЗУЧИЛ СПОСОБНОСТЬ МЕТАЛЛОВ ВЫТЕСНЯТЬ ИЗ РАСТВОРОВ СОЛЕЙ ДРУГИЕ МЕТАЛЛЫ. НА ОСНОВЕ ЭТИХ ИССЛЕДОВАНИЙ СОСТАВИЛ ВЫТЕСНИТЕЛЬНЫЙ РЯД МЕТАЛЛОВ

В 1892 Г В. НЕРНСТ ДОКАЗАЛ, ЧТО ВЫТЕСНИТЕЛЬНЫЙ РЯД ПРАКТИЧЕСКИ СОВПАДАЕТ С РЯДОМ В КОТОРОМ МЕТАЛЛЫ И ВОДОРОД РАСПОЛОЖЕНЫ В ПОРЯДКЕ УМЕНЬШЕНИЯ ИХ ВОССТАНОВИТЕЛЬНОЙ СПОСОБНОСТИ. ЭТОТ РЯД НАЗЫВАЮТ ЭЛЕКТРОХИМИЧЕСКИМ РЯДОМ НАПРЯЖЕНИЯ МЕТАЛЛОВ

ПРАВИЛА РЯДА НАПРЯЖЕНИЙ: МЕТАЛЛ ДОЛЖЕН НАХОДИТЬСЯВ РЯДУ НАПРЯЖЕНИЙ ДО МЕТАЛЛА СОЛИ;ОБЕ СОЛИ ДОЛЖНЫ БЫТЬ РАСТВОРИМЫМИ;НЕ РЕКОМЕНДУЕТСЯ ИСПОЛЬЗОВАТЬ АКТИВНЫЕ(ЩЕЛОЧНЫЕ) МЕТАЛЛЫ т.к ОНИ ВЗАИМОДЕЙСТВУЮТ С ВОДОЙ.

НАПИШИТЕ УРАВНЕНИЯ ВОЗМОЖНЫХ РЕАКЦИЙ K+ CuSO4Cu + Hg(NO3)2Fe + CuCl2Al + ZnSO4Zn + Al(NO3)3

ХЛОРИД ЖЕЛЕЗА(III) + НИТРАТ СЕРЕБРА= НИТРАТ КАЛИЯ+ ХЛОРИД НАТРИЯ=

ГИДРОКСИД НАТРИЯ+ СУЛЬФИД ЖЕЛЕЗА(II)=ГИДРОКСИД КАЛИЯ + СУЛЬФАТ ЖЕЛЕЗА(III) =

Химические свойства солей с + кислоты = о + щелочи = л + соли = и + М =