Презентация на тему: Простые и сложные вещества

Простые и сложные вещества Моцепуро ИванКласс 10 «а»Учитель: Макарова Е. И.Санкт-Петербург2009 год

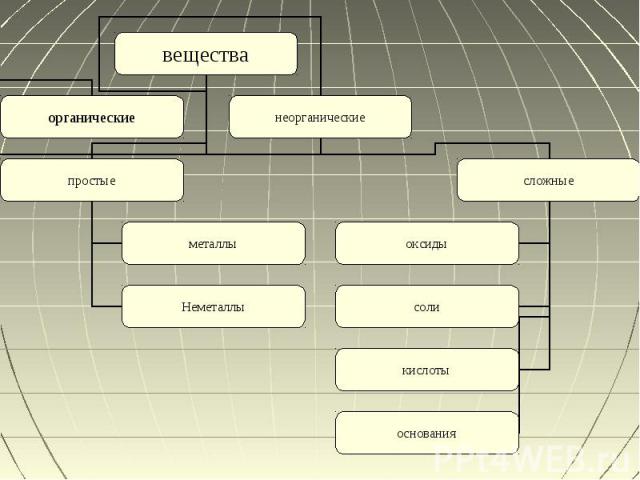
Содержание Вещества Неорганические соединенияКлассификация неорганических соединенийПростые веществаМеталлыНеметаллыАллотропияАгрегатное состояниеСложные веществаОксиды и их химические свойства Кислоты и их химические свойстваОснования и их химические свойстваСоли и их химические свойства
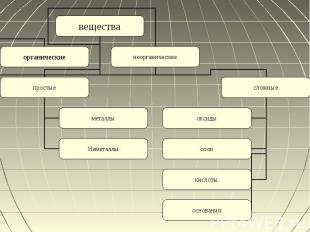

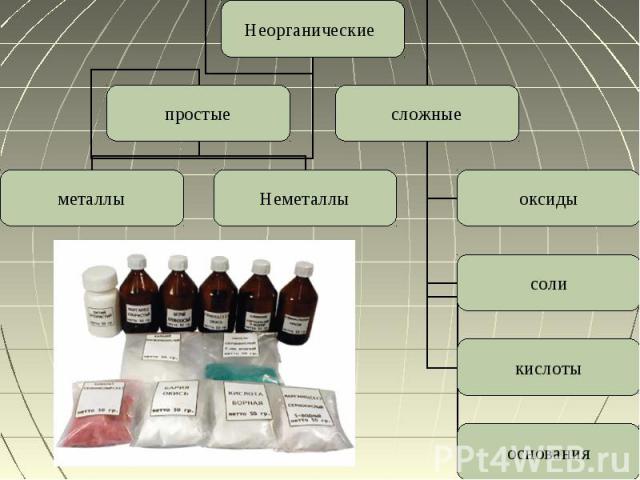
Неорганические вещества Неорганическое вещество или неорганическое соединение — это химическое вещество, химическое соединение, которое не является органическим, то есть они не содержат углерода. Неорганические соединения не имеют характерного для органических углеродного скелета.Делиться:По количеству элементовПо составуПо химическим свойствам
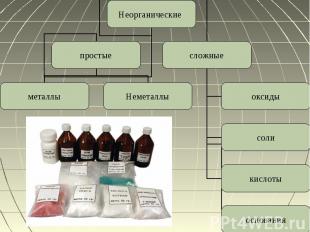

Простые вещества Простые вещества — вещества, состоящие исключительно из атомов одного химического элемента. Они делятся на неметаллы и металлыИзвестно свыше 400 разновидностей простых веществ

Металлы Металл (название происходит от лат. metallum — шахта) — группа элементов, обладающая характерными металлическими свойствами, такими как высокая тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и др.Из 117 химических элементов, открытых на данный момент, к металлам относят:6 элементов в группе щелочных металлов,4 в группе щелочноземельных металлов,38 в группе переходных металлов,11 в группе лёгких металлов,7 в группе полуметаллов,14 в группе лантаноиды + лантан,14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний

Неметаллы Неметаллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системыХарактерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов и проявлению более высокой окислительной активности, чем у металлов.

Аллотропные модификации Явление аллотропии может быть обусловлено либо различным составом молекул данного элемента, либо различным строением молекул и способом размещения молекул (атомов) в кристаллах. Способность элемента к образованию соответствующих аллотропных модификаций обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристалловРазличные аллотропные модификации могут переходить друг в друга. Для данного химического элемента его аллотропные модификации всегда различаются по физическим свойствам и химической активности

Агрегатное состояние При нормальных условиях, соответствующие простые вещества 11-ти элементов являются газами (H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, Rn), 2х — жидкостями (Br, Hg), остальных элементов — твёрдыми телами.При комнатной температуре (либо близкой к ней) 5 металлов находятся в жидком либо полужидком состоянии, так как их температура плавления близка к комнатной:Ртуть (−39 °C)Франций (27 °C)Цезий (28 °C)Галлий (30 °C)Рубидий (39 °C)
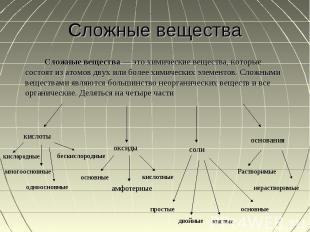
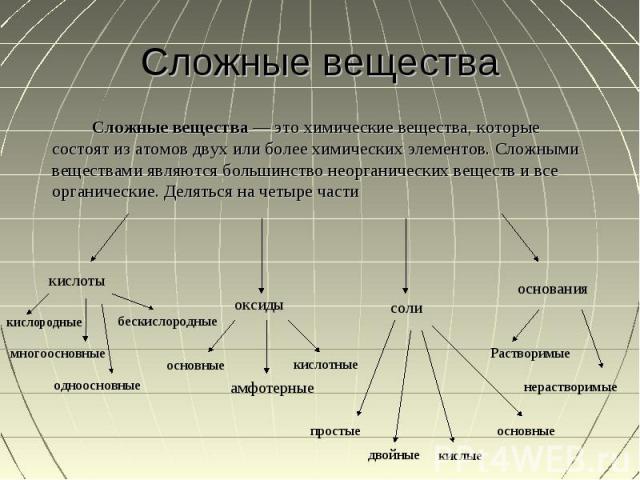
Сложные вещества Сложные вещества — это химические вещества, которые состоят из атомов двух или более химических элементов. Сложными веществами являются большинство неорганических веществ и все органические. Деляться на четыре части
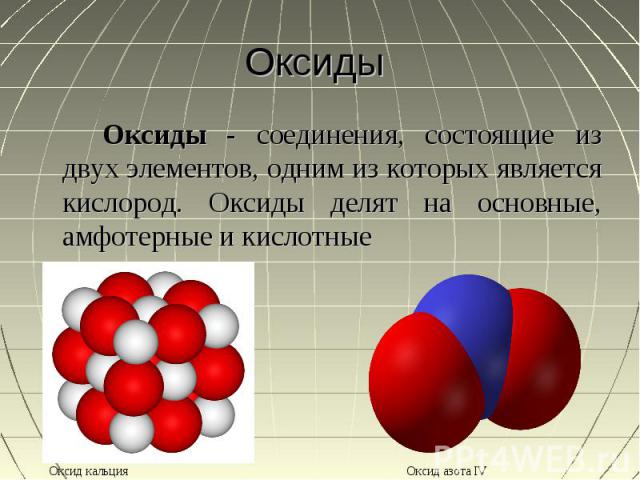
Оксиды Оксиды - соединения, состоящие из двух элементов, одним из которых является кислород. Оксиды делят на основные, амфотерные и кислотные

Химические свойства Основные оксиды1. Основный оксид + кислота = соль + водаCuO + H2SO4 = CuSO4 + H2O2. Сильноосновный оксид + вода = щелочьCaO + H2O = Ca(OH)23. Сильноосновный оксид + кислотный оксид = сольCaO + Mn2O7 = Ca(MnO4)2Na2O + CO2 = Na2CO34. Основный оксид + водород = металл + водаCuO + H2 = Cu + H2OКислотные оксиды1. Кислотный оксид + вода = кислотаSO3 + H2O = H2SO42. Кислотный оксид + основный оксид = сольCO2 + CaO = CaCO33. Кислотный оксид + основание = соль + водаSO2 + 2NaOH = Na2SO3 + H2OЕсли кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей:Ca(OH)2 + CO2 = CaCO3↓ + H2OCaCO3 + CO2 + H2O = Ca(HCO3)24. Нелетучий оксид + соль1 = соль2 + летучий оксидSiO2 + Na2CO3 = Na2SiO3 + CO2↑Амфотерные оксидыПри взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства:ZnO + 2HCl = ZnCl2 + H2OПри взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:ZnO + 2KOH + H2O = K2[Zn(OH)4)] (в водном растворе)ZnO + CaO = CaZnO2 (при сплавлении)
Кислоты Кислота — это электролит, отдающий электрон в реакции с основанием, то есть веществом, принимающим электрон. Кислоты бывают одноосновные, многоосновные, бескислородный, кислородные

Химические свойства Взаимодействие с оксидами металловВзаимодействие с амфотерными оксидамиВзаимодействие с щелочамиВзаимодействие с нерастворимыми основаниямиВзаимодействие с солями

Основания Основания — вещества, молекулы которых состоят из ионов металлов или иона аммония и одной (или нескольких) гидроксогруппы -OH.Бывают растворимыеи не растворимые

Химические свойства Действие на индикаторы: лакмус - синий, метилоранж - жёлтый, фенолфталеин - малиновый,2. Основание + кислота = Соли + вода Примечание:реакция не идёт, если и кислота, и щёлочь слабые. NaOH + HCl = NaCl + H2O3. Щёлочь + кислотный или амфотерный оксид = соли + вода2NaOH + SiO2 = Na2SiO3 + H2O4. Щёлочь + соли = (новое)основание + (новая) соль прим-е:исходные вещества должны быть в растворе, а хотя бы 1 из продуктов реакции выпасть в осадок или мало растворяться. Ba(OH)2 + Na2SO4 = BaSO4+ 2NaOH5.Слабые основания при нагреве разлагаются: Cu(OH)2+Q=CuO + H2O6.При нормальных условиях невозможно получить гидроксиды серебра и ртути, вместо них в реакции появляются вода и соответствующий оксид: AgNO3 + 2NaOH(p) → NaNO3+Ag2O+H2O

Соли Соли — вещества, состоящие из катионов металла и анионов кислотного остатка. Бывают простые, двойные, кислотные и основные

Химические свойства Соли взаимодействуют с кислотами и основаниями, если в результате реакции получается продукт, который выходит из сферы реакции (осадок, газ, мало диссоциирующие вещества, например, вода):Соли взаимодействуют с металлами, если свободный металл находится левее металла в составе соли в электрохимическом ряде активности металлов:Соли взаимодействуют между собой, если продукт реакции выходит из сферы реакции; в том числе эти реакции могут проходить с изменением степеней окисления атомов реагентов:Некоторые соли разлагаются при нагревании