Презентация на тему: Кальций

Кальций Работу выполнила : Реброва ЕкатеринаУчитель химии : Макарова Е.И653 школа

Содержание История происхождения кальцияСтроение атомаФизические свойстваХимические свойстваПолучениеПрименениеБиологическая роль кальция

Строение атома В периодической таблице химических элементов Д. И. Менделеева кальций Са расположен в 4-м периоде II группы главной подгруппы. Кальций Са — металл. Основная степень окисления 4-2.

История происхождения кальция Название элемента происходит от лат. calx (в родительном падеже calcis) — «известь», «мягкий камень». Оно было предложено английским химиком Хэмфри Дэви, в 1808 г. выделившим металлический кальций электролитическим методом.

Физические свойства По физическим свойствам: кальций — металл серебристо-белого цвета, относительно легкий (плотность р = 1,54), температура плавления 854 °С, окисляется на воздухе.

Химические свойства Кальций реагирует с водяными парами : 2Са + О2 = 2СаО Кальций реагирует с холодной водой с образованием гидроксида кальция : Са + 2Н2О = Са(ОН)2 + Н2 Кальций при нагревании реагирует со многими неметаллами — водородом, азотом, серой, фосфором, углеродом и др. : Са + Н2 = СаН2 (гидрид кальция) 3Са + N2 = Са3N2 (нитрид кальция) Са + S = СаS (сульфид кальция) Кальций восстанавливает менее активные металлы из их оксидов и галогенидов: 2Са + ТiO2 = 2СаО + Тi

Получение Свободный металлический кальций получают электролизом расплава, состоящего из CaCl2 (75-80 %) и KCl или из CaCl2 и CaF2, а также алюминотермическим восстановлением CaO при 1170—1200 °C:4CaO + 2Al = CaAl2O4 + 3Ca.
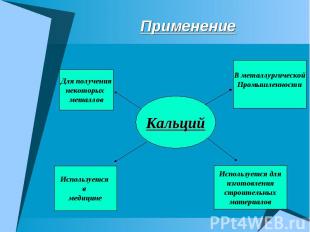
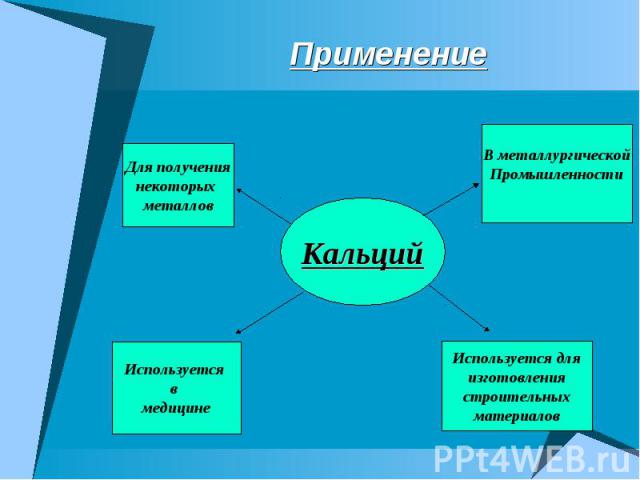
Применение

Биологическая роль кальция Кальций поддерживает нормальный сердечный ритм, как и магний, кальций способствует здоровью сердечно-сосудистой системы в целом участвует в обмене железа в организме, регулирует ферментную активность способствует нормальной работе нервной системы, передаче нервных импульсов действуя сообща, фосфор и кальций делают кости крепкими, а зубы здоровыми

СПАСИБО ЗА ВНИМАНИЕ!