Презентация на тему: Северная кислота и её свойства

Тема урока: СЕРНАЯ КИСЛОТА И ЕЁ СВОЙСТВА

Признаки характеристики кислоты по содержанию атомов кислорода в молекуле по основности по растворимости по степени электролитической диссоциации (т.е. по силе)по летучести по стабильности

Физические свойства кислоты Жидкость.Бесцветная, маслянистая.Растворима в воде в любых пропорциях.плотность кислоты 1,83г/мл. В природе в чистом виде встречается редкоОзеро с кислотой в вулканическом кратере на Камчатке

А как правильно ?

Химические( общие) свойства серной кислоты H2SO4 реагирует:с металлами, стоящими в электрохимическом ряду до водородас оксидами металловс основаниями с солями

Опыт №1 Взаимодействие кислоты с металлами Возьмите пробирку.Аккуратно опустите в неё кусочек цинка.Прилейте по стеночке, тонкой струйкой кислоту, так чтобы жидкость накрыла металл.Что наблюдаете?

Взаимодействие кислоты с металлами 0 +1 +2 0 Zn + H2S04 = ZnS04 + H2

Взаимодействие кислоты с металлами, стоящими после водорода 0 +6 +2 +4 Сu + H2S04 = CuS04 + S02 + H2O Возможные продукты реакции: S H2S04(конц.) + Ме(актив) H2S

Опыт №2 Взаимодействие кислоты с оксидами металлов Возьмите чистую пробиркуНасыпьте немного оксида меди (порошок черного цвета) .Прилейте кислоту, слегка прикрыв раствором вещество.Если изменений нет, слегка нагрейте пробирку на спиртовке.Что наблюдаете?

Качественная реакция на сульфат - ион Ba2+ +SO42- = BaSO4 белый осадок «Молоко»



Суммарную реакцию обжига колчедана можно представить в виде реакции FeS2 + 11O2 → 2Fe2O3 + 8SO2Выводы:Для успешного проведения процесса обжига пирита необходимо соблюдать следующие условия:1) Увеличивают концентрацию реагентов – вместо воздуха подают чистый кислород.2) Увеличение площади поверхности - дробление пирита до определённых размеров.3) Температура - +8000С.4) Принцип противотока.5) Принцип «кипящего слоя».
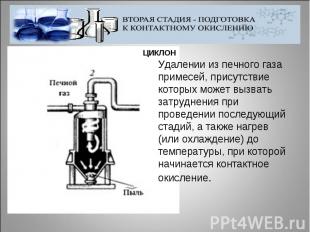
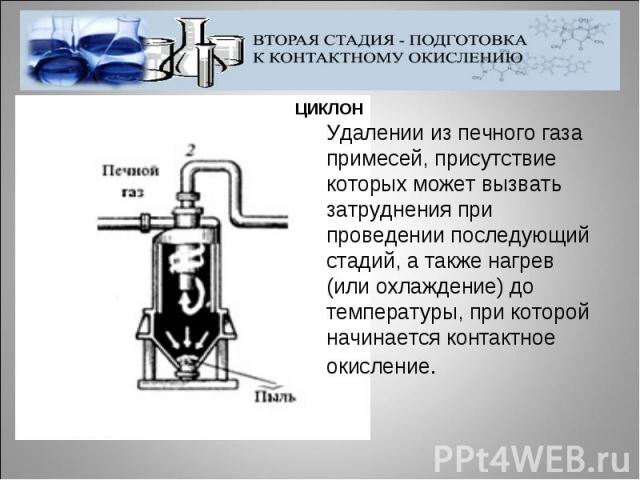
Удалении из печного газа примесей, присутствие которых может вызвать затруднения при проведении последующий стадий, а также нагрев (или охлаждение) до температуры, при которой начинается контактное окисление.

ЭЛЕКТРОФИЛЬТРОбжиговый или печной газ, полученный сжиганием колчедана в печах КС содержит большое количество огарковой пылиОчистка обжигового газа начинается в печном отделении, где в циклонах и сухих электрофильтрах пыль осаждают. Затем газ направляют на стадию мокрой очистки (в промывное отделение), где из обжигового газа удаляют остатки пыли.

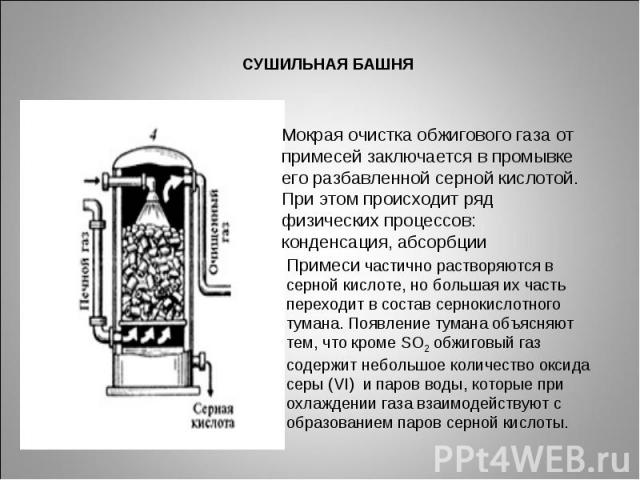
СУШИЛЬНАЯ БАШНЯМокрая очистка обжигового газа от примесей заключается в промывке его разбавленной серной кислотой. При этом происходит ряд физических процессов: конденсация, абсорбции Примеси частично растворяются в серной кислоте, но большая их часть переходит в состав сернокислотного тумана. Появление тумана объясняют тем, что кроме SO2 обжиговый газ содержит небольшое количество оксида серы (VI) и паров воды, которые при охлаждении газа взаимодействуют с образованием паров серной кислоты.

ТЕПЛООБМЕННИКТак как в процессе очистки в циклоне и электрофильтре газ остывает, то в теплообменнике очищенный и осушенный газ подогревают. Затем он поступает в контактный аппарат.

2SO2 + O2 → 2SO3 +197кДж Реакция окисления диоксида серы возможна лишь в присутствии катализатора. В промышленности основным катализатором окисления SO2 является оксид ванадия V2O5Скорость реакции повышается с ростом концентрации кислорода, поэтому процесс в промышленности проводят при его избытке.

Выводы:Подводя итог сказанному следует сделать вывод - для успешного проведения процесса производства серной кислоты на данной стадии необходимо соблюдать следующие условия:1) Температура от 400 до 600оС2) Использование катализатора V2O5 (ванадиевая контактная масса). 3) Повышение концентрации кислорода.

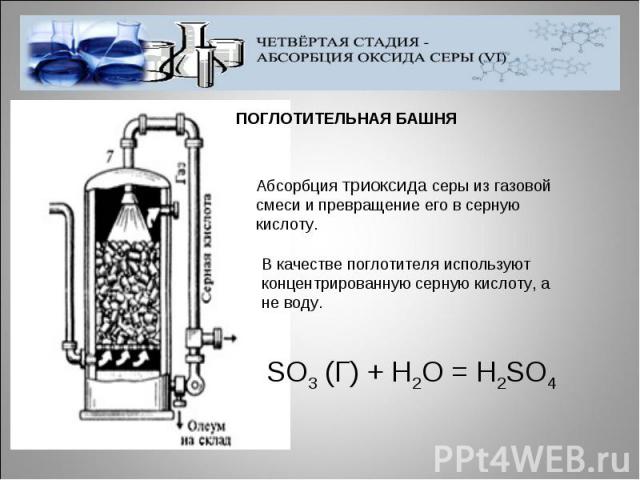
ПОГЛОТИТЕЛЬНАЯ БАШНЯАбсорбция триоксида серы из газовой смеси и превращение его в серную кислоту. В качестве поглотителя используют концентрированную серную кислоту, а не воду.

Общие выводы:Для успешного проведения процесса производства серной кислоты необходимо соблюдать следующие условия:1) Увеличивают концентрацию реагентов – вместо воздуха подают чистый кислород.2) Увеличение площади поверхности - дробление пирита до определённых размеров.3) Принцип теплообмена4) Принцип противотока.5) Принцип «кипящего слоя».