Презентация на тему: Химия неметаллов. Общая характеристика

Лекция № 14 Химия неметаллов. Общая характеристика. продолжение
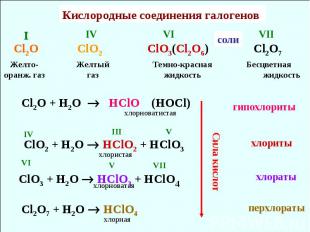
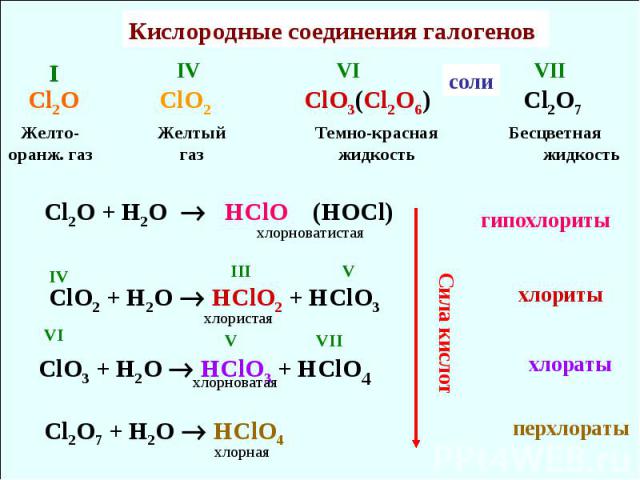
Кислородные соединения галогенов Cl2O ClO2 ClO3(Cl2O6) Cl2O7 Желто-оранж. газ Желтый газ Темно-красная жидкость IV VI I VII Бесцветная жидкость Cl2O + H2O HClO (HOCl) ClO2 + H2O HClO2 + HClO3 ClO3 + H2O HClO3 + HClO4 Cl2O7 + H2O HClO4 IV III V VI V VII хлорноватистая хлористая хлорноватая хлорная соли хлориты гипохлориты хлораты перхлораты Сила кислот
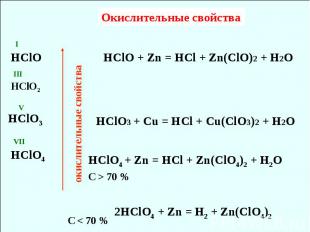
окислительные свойства Окислительные свойства VII V III I HClO HClO2 HClO3 HClO4 HClO + Zn = HCl + Zn(ClO)2 + H2O HClO3 + Cu = HCl + Cu(ClO3)2 + H2O 2HClO4 + Zn = H2 + Zn(ClO4)2 HClO4 + Zn = HCl + Zn(ClO4)2 + H2O С < 70 % С > 70 %

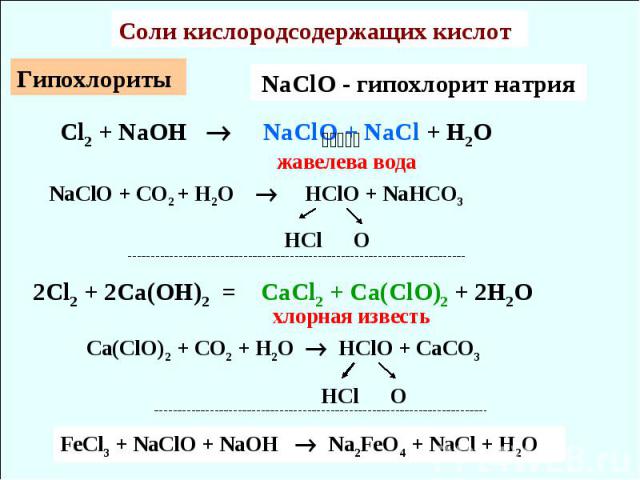
Cоли кислородсодержащих кислот Гипохлориты Cl2 + NaOH NaClO + NaCl + H2O жавелева вода NaClO + CO2 + H2O HClO + NaHCO3 HCl O NaClO - гипохлорит натрия Сa(ClO)2 + CO2 + H2O HClO + CaCO3 HCl O 2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O хлорная известь FeCl3 + NaClO + NaOH Na2FeO4 + NaCl + H2O
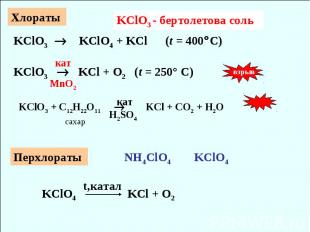
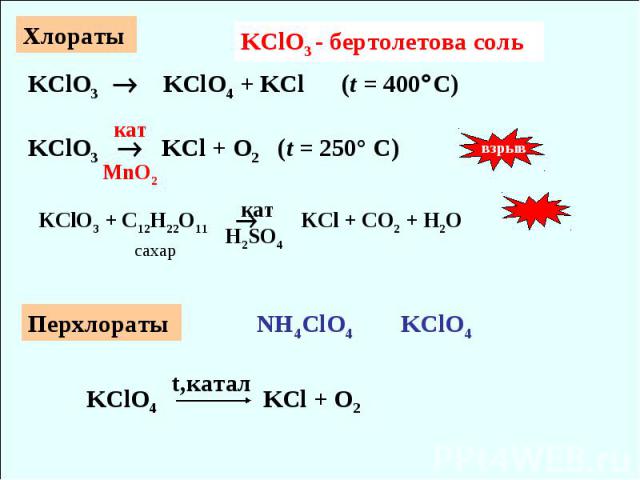
Хлораты KClO3 - бертолетова соль KClO3 KClO4 + KCl (t = 400C) кат KClO3 KCl + O2 (t = 250° C) MnO2 взрыв KClO3 + C12H22O11 KCl + CO2 + H2O сахар кат H2SO4 Перхлораты NH4ClO4 KClO4 KClO4 KCl + O2 t,катал

HBrO3 HIO3 Кислородсодержащие кислоты брома и йода Бромноватая кислота - броматы Йодноватая кислота - йодаты KIO3 + 3Na2SO3 KI + 3Na2SO4 KIO3 +5KI + 6HCl 3I2 + 6KCl + 3H2O

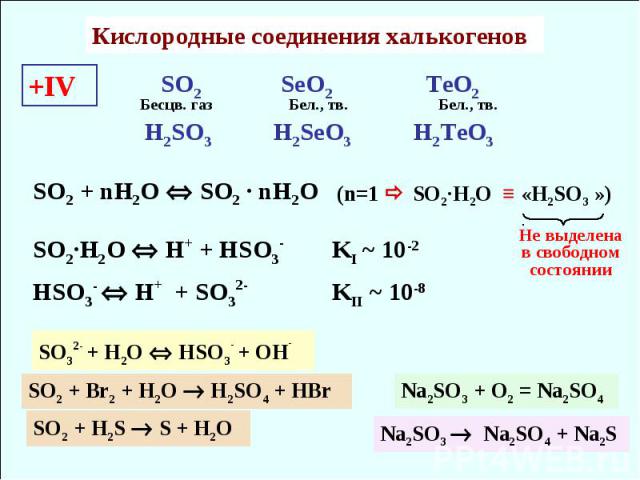
Кислородные соединения халькогенов +IV SO2 SeO2 TeO2 Бесцв. газ Бел., тв. Бел., тв. H2SO3 H2SeO3 H2TeO3 HSO3- H+ + SO32- KII ~ 10-8 SO2 + nH2O SO2 · nH2O (n=1 SO2·H2O ≡ «H2SO3 ») SO2·H2O H+ + HSO3- KI ~ 10-2 Не выделена в свободном состоянии SO32- + H2O HSO3- + OH- SO2 + Br2 + H2O H2SO4 + HBr SO2 + H2S S + H2O Na2SO3 + O2 = Na2SO4 Na2SO3 Na2SO4 + Na2S
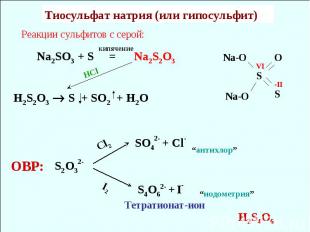
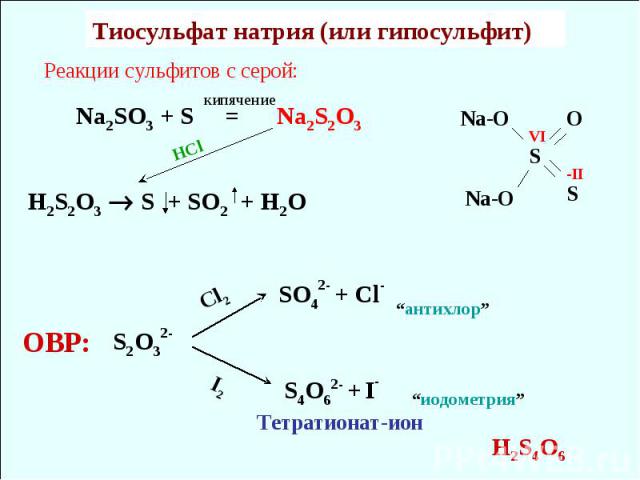
Реакции сульфитов с серой: Na2SO3 + S = Na2S2O3 H2S2O3 S + SO2 + H2O HCl Тиосульфат натрия (или гипосульфит) кипячение S2O32- Cl2 SO42- + Cl- S4O62- + I- I2 Тетратионат-ион ОВР: “антихлор” “иодометрия” H2S4O6 S O S Na-O Na-O VI -II
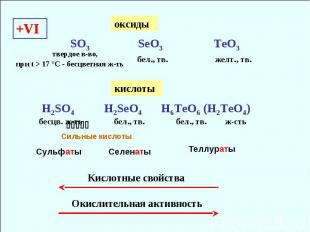
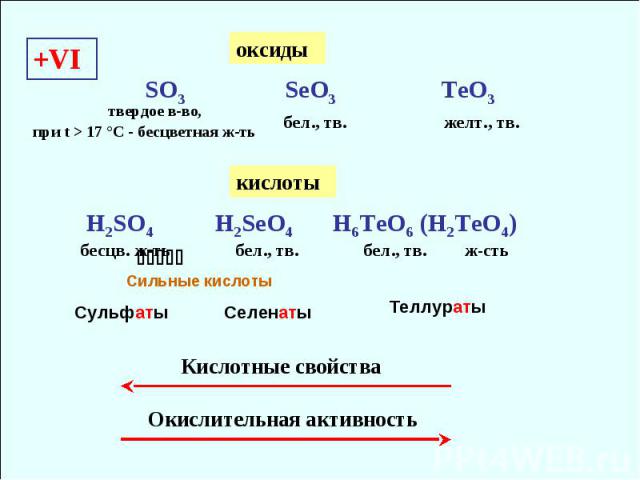
+VI SO3 SeO3 TeO3 бел., тв. желт., тв. Кислотные свойства H2SO4 H2SeO4 H6TeO6 (H2TeO4) бесцв. ж-ть бел., тв. бел., тв. Окислительная активность ж-сть Сильные кислоты оксиды кислоты Сульфаты Селенаты Теллураты твердое в-во, при t > 17 °С - бесцветная ж-ть

H2SO4 98,3 % р-р H2SO4: = 1,84 г/см3, t.кип. 338 С, SO3 + H2O = H2SO4 H2SO4 •nSO3 - олеум t.затв. 10,4 °C H < 0 C12H22O11 (тв.) H2SO4(конц) – 11H2O(ж.) 12С(тв.) сахароза NaHSO4 и Na2SO4 H2SO4(разб) H2SO4(разб) + Fe FeSO4 + H2 H2SO4(разб) + Cu H2SO4(конц) H2SO4(конц) + Mg MgSO4 + H2 S + H2O H2SO4(конц) + Cu CuSO4 + SO2 + H2O 1. 2. 3. 4.

Соли – сульфаты и гидросульфаты. BaSO4, SrSO4, PbSO4 видио №11 CuSO4 · 5H2O FeSO4 · 7H2O ZnSO4 · 7H2O - медный купорос - железный купорос - цинковый купорос - квасцы MIMIII(SO4)2 · nH2O KAl(SO4)2 · 12H2O KCr(SO4)2 · 12H2O - алюмокалиевые квасцы - хромокалиевые квасцы Имеют наибольшее практическое значение: - фотография - медицина - крашение тканей - медицина Cоли серной кислоты - производство бумаги

H2SO4·nSO3 - олеум Пиросерная (двусерная) кислота и ее соли (H2SO4 · SO3 ) 2KHSO4 K2S2O7 + H2SO4 до 240°С K2S2O7 K2SO4 + SO3 >35°С SO3 + H2SO4 H2S2O7 Пероксодисерная кислота и ее соли электролиз 2H2SO4 H2S2O8 + H2 H2SO4 H+ + HSO4 K2S2O8 + KI = K2SO4 + I2 полуреакция для окислителя полуреакция для восстановителя 2I- - 2e = I2 S2O8- + 2e = 2SO42-
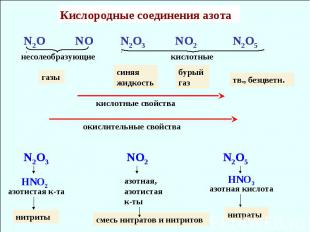
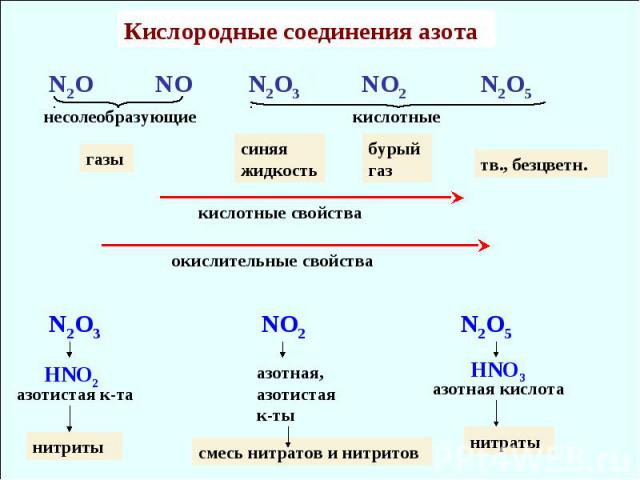
Кислородные соединения азота N2O NO N2O3 NO2 N2O5 несолеобразующие кислотные кислотные свойства газы тв., безцветн. окислительные свойства синяя жидкость бурый газ N2O3 NO2 N2O5 HNO2 HNO3 азотистая к-та нитриты азотная, азотистая к-ты смесь нитратов и нитритов азотная кислота нитраты
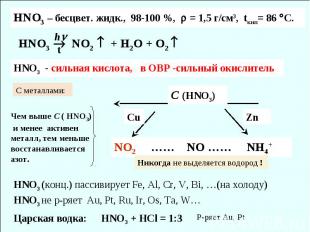
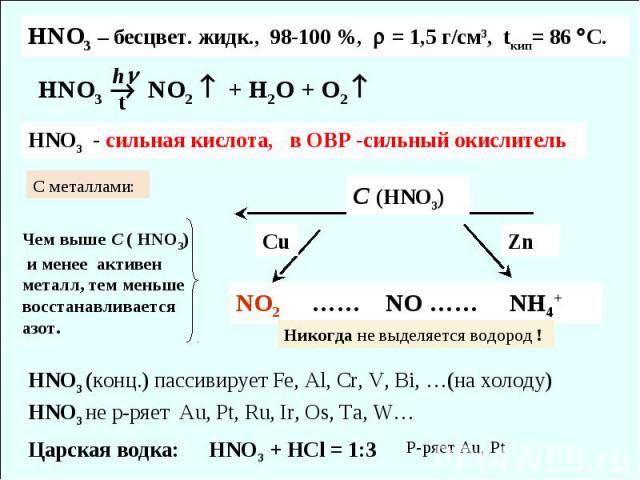
HNO3 NO2 + H2O + O2 h HNO3 – бесцвет. жидк., 98-100 %, = 1,5 г/см3, tкип= 86 С. HNO3 - сильная кислота, в ОВР -сильный окислитель t NO2 …… NO …… NH4+ С (HNO3) Cu Zn Чем выше C ( HNO3) и менее активен металл, тем меньше восстанавливается азот. Никогда не выделяется водород ! HNO3 (конц.) пассивирует Fe, Al, Cr, V, Bi, …(на холоду) HNO3 не р-ряет Au, Pt, Ru, Ir, Os, Ta, W… Царская водка: HNO3 + HCl = 1:3 Р-ряет Au, Pt C металлами:
![Au + HNO3 + HCl H[AuCl4] + NO + H2O HNO3 + S H2SO4 + NO HNO3 + P + H2O H3PO4 + N Au + HNO3 + HCl H[AuCl4] + NO + H2O HNO3 + S H2SO4 + NO HNO3 + P + H2O H3PO4 + N](https://fs1.ppt4web.ru/images/3018/65142/310/img14.jpg)
Au + HNO3 + HCl H[AuCl4] + NO + H2O HNO3 + S H2SO4 + NO HNO3 + P + H2O H3PO4 + NO C неметаллами: Нитраты: При нагревании разлагаются с выделение кислорода (О2) NaNO3 NaNO2 + O2 Pb(NO3)2 PbO + NO2 + O2 AgNO3 Ag + NO2 +O2 Эл.-хим. ряд напряжений Меt. До Mg: От Mg до Сu : После Cu : Нитраты натрия, калия, аммония, кальция - селитры в ОВР : Fe2O3 + KNO3 + KOH K2FeO4 + KNO2 + H2O

N2O3 + H2O HNO2 нестойкая, слабая к-та, сущ-ет в водном р-ре при низких тем-рах Разлагается: HNO2 HNO3 + NO + H2O Хорошо растворимы в воде (кроме AgNO2), ядовиты N2O3 NO + NO2 t = 3,5 HNO2 - азотистая кислота Нитриты В ОВР – двойственная природа: NaNO2 + NaClO3 NaNO3 + NaCl восстановитель NaNO2 + NaI + H2SO4 NO + I2 + Na2SO4 + H2O окислитель Реакции диспропорционирования: 3HNO2 HNO3 + 2NO + H2O

LiNO2 Li2O + NO + O2 Cd(NO2)2 CdO + NO + NO2 AgNO2 Ag + NO2 Термическое разложение нитритов: NH4NO2 N2 + H2O - щелочных металлов: t t - других металлов: - благородных металлов: - аммония: t t Нитриты натрия, калия находят применение в пищевой промышленности, в производстве красителей, в фотографии







![Au + HNO3 + HCl H[AuCl4] + NO + H2O HNO3 + S H2SO4 + NO HNO3 + P + H2O H3PO4 + NO C неметаллами: Нитраты: При нагревании разлагаются с выделение кислорода (О2) NaNO3 NaNO2 + O2 Pb(NO3)2 PbO + NO2 + O2 AgNO3 Ag + NO2 +O2 Эл.-хим. ряд напряжений Меt. … Au + HNO3 + HCl H[AuCl4] + NO + H2O HNO3 + S H2SO4 + NO HNO3 + P + H2O H3PO4 + NO C неметаллами: Нитраты: При нагревании разлагаются с выделение кислорода (О2) NaNO3 NaNO2 + O2 Pb(NO3)2 PbO + NO2 + O2 AgNO3 Ag + NO2 +O2 Эл.-хим. ряд напряжений Меt. …](https://fs1.ppt4web.ru/images/3018/65142/640/img14.jpg)













