Презентация на тему: Комплексные соединения

Комплексные соединения Лекция № 9

Что такое комплексные соединения? Как они образуются? NH3, H2O, CO2, KI, HgCl2, CoCl2, … валентнонасыщенные мол-лы (соединения первого порядка): молекулярные соединения (соединения высшего порядка): гидраты, аммиакаты, двойные соли, … CoCl3 + 6NH3 = CoCl3 · 6NH3 1. HgCl2 + 2KI =HgI2 + 2KCl HgI2 + 2KI = K2HgI4 2. CuSO4 · 5H2O K2SO4 · Al2(SO4)3 3. 4.

Основные положения координационной теории Вернера Что такое комплексная частица ? Комплексообразователь: атом металла в положительной СО СО комплексообразователя + суммарный заряд лигандов = заряд комплексной частицы Этот заряд компенсируется внешнесферными ионами Связь комплексообразователя с лигандами более прочная нежели с внешнесферными ионами Координационное число комплексообразователя: число лигандов на внутренней сфере. Обычно равно удвоенной СО комплексообразователя. Определяет структуру комплекса. • • • • •
![[PtIV(NH3)6]Cl4 [PtIV(NH3)5Cl]Cl3 [PtIV(NH3)4Cl2]Cl2 [PtIV(NH3)3Cl3]Cl [PtIV(NH3 [PtIV(NH3)6]Cl4 [PtIV(NH3)5Cl]Cl3 [PtIV(NH3)4Cl2]Cl2 [PtIV(NH3)3Cl3]Cl [PtIV(NH3](https://fs1.ppt4web.ru/images/3018/65399/310/img3.jpg)
[PtIV(NH3)6]Cl4 [PtIV(NH3)5Cl]Cl3 [PtIV(NH3)4Cl2]Cl2 [PtIV(NH3)3Cl3]Cl [PtIV(NH3)2Cl4] От эмпирических формул КС к координационным: PtCl4 • 2NH3 PtCl4 • 6NH3 PtCl4 • 5NH3 PtCl4 • 4NH3 PtCl4 • 3NH3
![NH3 NH3 NH3 NH3 NH3 NH3 CoIII [Co(NH3)6]3+ x + 0 = 3 III Октаэдр 6 NH3 NH3 NH3 NH3 NH3 NH3 CoIII [Co(NH3)6]3+ x + 0 = 3 III Октаэдр 6](https://fs1.ppt4web.ru/images/3018/65399/310/img4.jpg)
NH3 NH3 NH3 NH3 NH3 NH3 CoIII [Co(NH3)6]3+ x + 0 = 3 III Октаэдр 6
![F–Ј F–Ј F–Ј BIII [BF4]– F–Ј x – 4 = –1 III 4 Тетраэдр F–Ј F–Ј F–Ј BIII [BF4]– F–Ј x – 4 = –1 III 4 Тетраэдр](https://fs1.ppt4web.ru/images/3018/65399/310/img5.jpg)
F–Ј F–Ј F–Ј BIII [BF4]– F–Ј x – 4 = –1 III 4 Тетраэдр
![[PtCl4]2– Квадрат ◒ ◒ ◒ ◒ ● Сl– Сl–Ј Сl– Сl– x – 4 = –2 II PtII 4 [PtCl4]2– Квадрат ◒ ◒ ◒ ◒ ● Сl– Сl–Ј Сl– Сl– x – 4 = –2 II PtII 4](https://fs1.ppt4web.ru/images/3018/65399/310/img6.jpg)
[PtCl4]2– Квадрат ◒ ◒ ◒ ◒ ● Сl– Сl–Ј Сl– Сl– x – 4 = –2 II PtII 4
![[Ag(CN)2]– ◑ ◐ ● Линейная стуктура СN– CN– x – 2 = –1 I AgI 2 [Ag(CN)2]– ◑ ◐ ● Линейная стуктура СN– CN– x – 2 = –1 I AgI 2](https://fs1.ppt4web.ru/images/3018/65399/310/img7.jpg)
[Ag(CN)2]– ◑ ◐ ● Линейная стуктура СN– CN– x – 2 = –1 I AgI 2
![Полидентатные лиганды: СH2 – СH2 ╱ ╲ H2N NH2 [Co(en)3]3+ C2O42– Этилендиамин (en Полидентатные лиганды: СH2 – СH2 ╱ ╲ H2N NH2 [Co(en)3]3+ C2O42– Этилендиамин (en](https://fs1.ppt4web.ru/images/3018/65399/310/img8.jpg)
Полидентатные лиганды: СH2 – СH2 ╱ ╲ H2N NH2 [Co(en)3]3+ C2O42– Этилендиамин (en) Оксалат-ион [Fe(C2O4)3]3-

Номенклатура КС NaCl, K2SO4, … ⇦ Порядок перечисления фрагментов комплексной частицы: Заряженные лиганды (Cl — хлоро, ОН– — гидроксо, CN– — циано) с указанием их числа (ди-, три-, тетра- …) Нейтральные лиганды (Н2О — аква, NH3 — аммин и т.п.) Комплексообразователь (в катионе — русское название, в анионе — латинское с окончанием -ат) СО комплексообразователя
![[Zn(NH3)4]SO4 [Co(H2O)2(NH3)3Cl]Cl2 Хлорид хлоротриамминдиаквакобальта (III) Сул [Zn(NH3)4]SO4 [Co(H2O)2(NH3)3Cl]Cl2 Хлорид хлоротриамминдиаквакобальта (III) Сул](https://fs1.ppt4web.ru/images/3018/65399/310/img10.jpg)
[Zn(NH3)4]SO4 [Co(H2O)2(NH3)3Cl]Cl2 Хлорид хлоротриамминдиаквакобальта (III) Сульфат тетраамминцинка (II) x – 1 = 2 III K4 [Fe(CN)6] II Гексацианоферрат (II) калия (жёлтая кровяная соль) NH4[Cr(NH3)2(SCN)4] x – 4 = –1 III Тетрароданодиамминхромат (III) аммония [Al(H2O)3(OH)3] Тригидроксотриакваалюминий
![Диссоциация КС в водных растворах [Cu(NH3)4]SO4 = [Cu(NH3)4]2+ +SO42– [Cu(NH3)4] Диссоциация КС в водных растворах [Cu(NH3)4]SO4 = [Cu(NH3)4]2+ +SO42– [Cu(NH3)4]](https://fs1.ppt4web.ru/images/3018/65399/310/img11.jpg)
Диссоциация КС в водных растворах [Cu(NH3)4]SO4 = [Cu(NH3)4]2+ +SO42– [Cu(NH3)4]2+ ⇄ Cu2+ + 4NH3 Скомпл≫ Спрод.дисс [Cu2+] [NH3]4 Kн = ——————— = 2 · 10–13 [ [Cu(NH3)4]2+] α =1 α

Двойные соли: (NH4)2SO4 ∙ FeSO4 ∙ 6H2O (соль Мора) KAl(SO4)2 ∙ 12H2O (алюмокалиевые квасцы) (NH4)2[Fe(SO4)2](k)= 2NH4+ + Fe2+ + 2SO42– K[Al(SO4)2](k) = K+ + Al3+ + 2SO42– Скомпл < Спрод.дисс О связи Кн с устойчивостью комплексной частицы
![Важнейшие типы КС AlCl3 ∙ 6H2O ≡ [Al(H2O)6]Cl3 Если лигандами является вода комп Важнейшие типы КС AlCl3 ∙ 6H2O ≡ [Al(H2O)6]Cl3 Если лигандами является вода комп](https://fs1.ppt4web.ru/images/3018/65399/310/img13.jpg)
Важнейшие типы КС AlCl3 ∙ 6H2O ≡ [Al(H2O)6]Cl3 Если лигандами является вода комплексы называются аквакомплексами [Co(H2O)6]2+ [Ni(H2O)6] 2 + Как правило, аквакомплексы неустойчивы Аквакомплексы образуются при выделении солей из водных растворов в виде кристаллогидратов Аквакомплексы 1.
![Амминокомплексы 2. В амминокомплексах лигандами являются молекулы NH3 [Cu(NH3)4] Амминокомплексы 2. В амминокомплексах лигандами являются молекулы NH3 [Cu(NH3)4]](https://fs1.ppt4web.ru/images/3018/65399/310/img14.jpg)
Амминокомплексы 2. В амминокомплексах лигандами являются молекулы NH3 [Cu(NH3)4]2+ [Ni(NH3)6]2+ ZnSO4 + 2NH3 ∙ H2O = Zn(OH)2↓ + (NH4)2SO4 Zn(OH)2 + 4NH3 = [Zn(NH3)4](OH)2 комплексный гидроксид цинка Комплексные гидроксиды относятся к сильным основаниям

Ацидокомплексы 3. В ацидокомплексах лигандами являются анионы различных кислот. К ним относятся цианидные, галогенидные, карбонатные, оксалатные и другие комплексы. Na[Au(CN)2] - безцветный K2[SiF6] H2[SiF6] кремнефтористо- водородная кислота Комплексные кислоты относятся к сильным электролитам Hg(NO3)2 + 2KI = HgI2↓ + 2KNO3 HgI2 + 2KI = K2[HgI4] тетраиодомеркурат (II) калия (реактив Несслера)
![Be(OH)2 + 2NaOH = Na2[Be(OH)4] Гидроксокомплексы 4. В гидроксокомплексах лиганда Be(OH)2 + 2NaOH = Na2[Be(OH)4] Гидроксокомплексы 4. В гидроксокомплексах лиганда](https://fs1.ppt4web.ru/images/3018/65399/310/img16.jpg)
Be(OH)2 + 2NaOH = Na2[Be(OH)4] Гидроксокомплексы 4. В гидроксокомплексах лигандами являются ионы ОН- Na3[Al(OH)6] K2[Sn(OH)6] BeCl2 + 2NaOH = Be(OH)2↓ + 2NaCl Гидроксокомплексы образуют металлы, чьи гидроксиды амфотерны
![[Cu(NH3)4]2+ [Cu(en)2]2+ H3N NH3 CuII H3N NH3 CH2— NH2 H2N — CH2 CuII CH2— NH2 H [Cu(NH3)4]2+ [Cu(en)2]2+ H3N NH3 CuII H3N NH3 CH2— NH2 H2N — CH2 CuII CH2— NH2 H](https://fs1.ppt4web.ru/images/3018/65399/310/img17.jpg)
[Cu(NH3)4]2+ [Cu(en)2]2+ H3N NH3 CuII H3N NH3 CH2— NH2 H2N — CH2 CuII CH2— NH2 H2N — CH2 Правило Чугаева: наиболее устойчивы хелаты с 5–6-членными циклами Хелаты В хелатах комплексообразователь и лиганды образуют замкнутые циклы Хелаты отличаются повышенной прочностью “Хелат” –клешни рака
![Природа химической связи в КС [Zn(NH3)4]Cl2 Ионная связь Ковалентная связь ? – Природа химической связи в КС [Zn(NH3)4]Cl2 Ионная связь Ковалентная связь ? –](https://fs1.ppt4web.ru/images/3018/65399/310/img18.jpg)
Природа химической связи в КС [Zn(NH3)4]Cl2 Ионная связь Ковалентная связь ? –
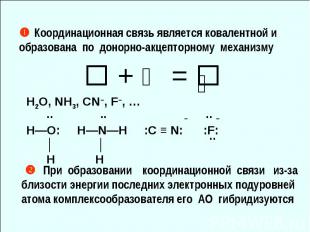
Координационная связь является ковалентной и образована по донорно-акцепторному механизму + ⇅ = ⇅ H2O, NH3, CN–, F–, … .. .. – .. – H—O: H—N—H :С ≡ N: :F: │ │ H H При образовании координационной связи из-за близости энергии последних электронных подуровней атома комплексообразователя его АО гибридизуются ..
3 Cr0 [Ar] 3d54s1 Cr3+ [Cr(H2O)6]3+ ↑ ↑ ↑ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ↑ [Cr(H2O)6](NO3)3 Cr0 [Ar] 3d54s1 Cr3+ [Cr(H2O)6]3+ ↑ ↑ ↑ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ↑](https://fs1.ppt4web.ru/images/3018/65399/310/img20.jpg)
[Cr(H2O)6](NO3)3 Cr0 [Ar] 3d54s1 Cr3+ [Cr(H2O)6]3+ ↑ ↑ ↑ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ↑ ↑ ↑ d2sp3 октаэдр 6 [Cr(H2O)6](NO3)3 - парамагнетик
![K4[Fe(CN)6] Fe0 [Ar] 3d64s2 Fe2+ [Fe(CN)6]4– ⇅ ↑ ↑ ↑ ↑ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ K4[Fe(CN)6] Fe0 [Ar] 3d64s2 Fe2+ [Fe(CN)6]4– ⇅ ↑ ↑ ↑ ↑ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅](https://fs1.ppt4web.ru/images/3018/65399/310/img21.jpg)
K4[Fe(CN)6] Fe0 [Ar] 3d64s2 Fe2+ [Fe(CN)6]4– ⇅ ↑ ↑ ↑ ↑ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ d2sp3 октаэдр K4[Fe(CN)6] - диамагнетик μ = 0 6
![[Ni(NH3)6]Br2 Ni0 [Ar] 3d84s2 Ni2+ ⇅ ⇅ ⇅ ↑ ↑ 3d 4s 4p sp3d2 октаэдр μ > 0 [Ni(NH [Ni(NH3)6]Br2 Ni0 [Ar] 3d84s2 Ni2+ ⇅ ⇅ ⇅ ↑ ↑ 3d 4s 4p sp3d2 октаэдр μ > 0 [Ni(NH](https://fs1.ppt4web.ru/images/3018/65399/310/img22.jpg)
[Ni(NH3)6]Br2 Ni0 [Ar] 3d84s2 Ni2+ ⇅ ⇅ ⇅ ↑ ↑ 3d 4s 4p sp3d2 октаэдр μ > 0 [Ni(NH3)6]2+ … ⇅ ⇅ ⇅ ↑ ↑ 3d 4s 4p 4d ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ 6
![Na2[Zn(OH)4] Zn0 [Ar] 3d104s2 Zn2+ [Zn(OH)4]2–Ј ⇅ ⇅ ⇅ ⇅ ⇅ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ Na2[Zn(OH)4] Zn0 [Ar] 3d104s2 Zn2+ [Zn(OH)4]2–Ј ⇅ ⇅ ⇅ ⇅ ⇅ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅](https://fs1.ppt4web.ru/images/3018/65399/310/img23.jpg)
Na2[Zn(OH)4] Zn0 [Ar] 3d104s2 Zn2+ [Zn(OH)4]2–Ј ⇅ ⇅ ⇅ ⇅ ⇅ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ sp3 тетраэдр 4
![K2[Ni(CN)4] Ni0 [Ar] 3d84s2 Ni2+ [Ni(СN)4]2–Ј ⇅ ⇅ ⇅ ↑ ↑ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ K2[Ni(CN)4] Ni0 [Ar] 3d84s2 Ni2+ [Ni(СN)4]2–Ј ⇅ ⇅ ⇅ ↑ ↑ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅](https://fs1.ppt4web.ru/images/3018/65399/310/img24.jpg)
K2[Ni(CN)4] Ni0 [Ar] 3d84s2 Ni2+ [Ni(СN)4]2–Ј ⇅ ⇅ ⇅ ↑ ↑ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ dsp2 квадрат μ = 0 4
![[Ag(NH3)2]Cl Ag0 [Kr] 4d105s1 Ag+ [Ag(NH3)2]+ ⇅ ⇅ ⇅ ⇅ ⇅ 4d 5s 5p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ s [Ag(NH3)2]Cl Ag0 [Kr] 4d105s1 Ag+ [Ag(NH3)2]+ ⇅ ⇅ ⇅ ⇅ ⇅ 4d 5s 5p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ s](https://fs1.ppt4web.ru/images/3018/65399/310/img25.jpg)
[Ag(NH3)2]Cl Ag0 [Kr] 4d105s1 Ag+ [Ag(NH3)2]+ ⇅ ⇅ ⇅ ⇅ ⇅ 4d 5s 5p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ sp линейная структура 2




![[PtIV(NH3)6]Cl4 [PtIV(NH3)5Cl]Cl3 [PtIV(NH3)4Cl2]Cl2 [PtIV(NH3)3Cl3]Cl [PtIV(NH3)2Cl4] От эмпирических формул КС к координационным: PtCl4 • 2NH3 PtCl4 • 6NH3 PtCl4 • 5NH3 PtCl4 • 4NH3 PtCl4 • 3NH3 [PtIV(NH3)6]Cl4 [PtIV(NH3)5Cl]Cl3 [PtIV(NH3)4Cl2]Cl2 [PtIV(NH3)3Cl3]Cl [PtIV(NH3)2Cl4] От эмпирических формул КС к координационным: PtCl4 • 2NH3 PtCl4 • 6NH3 PtCl4 • 5NH3 PtCl4 • 4NH3 PtCl4 • 3NH3](https://fs1.ppt4web.ru/images/3018/65399/640/img3.jpg)
![NH3 NH3 NH3 NH3 NH3 NH3 CoIII [Co(NH3)6]3+ x + 0 = 3 III Октаэдр 6 NH3 NH3 NH3 NH3 NH3 NH3 CoIII [Co(NH3)6]3+ x + 0 = 3 III Октаэдр 6](https://fs1.ppt4web.ru/images/3018/65399/640/img4.jpg)
![F–Ј F–Ј F–Ј BIII [BF4]– F–Ј x – 4 = –1 III 4 Тетраэдр F–Ј F–Ј F–Ј BIII [BF4]– F–Ј x – 4 = –1 III 4 Тетраэдр](https://fs1.ppt4web.ru/images/3018/65399/640/img5.jpg)
![[PtCl4]2– Квадрат ◒ ◒ ◒ ◒ ● Сl– Сl–Ј Сl– Сl– x – 4 = –2 II PtII 4 [PtCl4]2– Квадрат ◒ ◒ ◒ ◒ ● Сl– Сl–Ј Сl– Сl– x – 4 = –2 II PtII 4](https://fs1.ppt4web.ru/images/3018/65399/640/img6.jpg)
![[Ag(CN)2]– ◑ ◐ ● Линейная стуктура СN– CN– x – 2 = –1 I AgI 2 [Ag(CN)2]– ◑ ◐ ● Линейная стуктура СN– CN– x – 2 = –1 I AgI 2](https://fs1.ppt4web.ru/images/3018/65399/640/img7.jpg)
![Полидентатные лиганды: СH2 – СH2 ╱ ╲ H2N NH2 [Co(en)3]3+ C2O42– Этилендиамин (en) Оксалат-ион [Fe(C2O4)3]3- Полидентатные лиганды: СH2 – СH2 ╱ ╲ H2N NH2 [Co(en)3]3+ C2O42– Этилендиамин (en) Оксалат-ион [Fe(C2O4)3]3-](https://fs1.ppt4web.ru/images/3018/65399/640/img8.jpg)

![[Zn(NH3)4]SO4 [Co(H2O)2(NH3)3Cl]Cl2 Хлорид хлоротриамминдиаквакобальта (III) Сульфат тетраамминцинка (II) x – 1 = 2 III K4 [Fe(CN)6] II Гексацианоферрат (II) калия (жёлтая кровяная соль) NH4[Cr(NH3)2(SCN)4] x – 4 = –1 III Тетрароданодиамминхромат (I… [Zn(NH3)4]SO4 [Co(H2O)2(NH3)3Cl]Cl2 Хлорид хлоротриамминдиаквакобальта (III) Сульфат тетраамминцинка (II) x – 1 = 2 III K4 [Fe(CN)6] II Гексацианоферрат (II) калия (жёлтая кровяная соль) NH4[Cr(NH3)2(SCN)4] x – 4 = –1 III Тетрароданодиамминхромат (I…](https://fs1.ppt4web.ru/images/3018/65399/640/img10.jpg)
![Диссоциация КС в водных растворах [Cu(NH3)4]SO4 = [Cu(NH3)4]2+ +SO42– [Cu(NH3)4]2+ ⇄ Cu2+ + 4NH3 Скомпл≫ Спрод.дисс [Cu2+] [NH3]4 Kн = ——————— = 2 · 10–13 [ [Cu(NH3)4]2+] α =1 α Диссоциация КС в водных растворах [Cu(NH3)4]SO4 = [Cu(NH3)4]2+ +SO42– [Cu(NH3)4]2+ ⇄ Cu2+ + 4NH3 Скомпл≫ Спрод.дисс [Cu2+] [NH3]4 Kн = ——————— = 2 · 10–13 [ [Cu(NH3)4]2+] α =1 α](https://fs1.ppt4web.ru/images/3018/65399/640/img11.jpg)
= 2NH4+ + Fe2+ + 2SO42– K[Al(SO4)2](k) = K+ + Al3+ + 2SO42– Скомпл < Спрод.дисс О связи Кн с устойчивостью комплексной частицы Двойные соли: (NH4)2SO4 ∙ FeSO4 ∙ 6H2O (соль Мора) KAl(SO4)2 ∙ 12H2O (алюмокалиевые квасцы) (NH4)2[Fe(SO4)2](k)= 2NH4+ + Fe2+ + 2SO42– K[Al(SO4)2](k) = K+ + Al3+ + 2SO42– Скомпл < Спрод.дисс О связи Кн с устойчивостью комплексной частицы](https://fs1.ppt4web.ru/images/3018/65399/640/img12.jpg)
![Важнейшие типы КС AlCl3 ∙ 6H2O ≡ [Al(H2O)6]Cl3 Если лигандами является вода комплексы называются аквакомплексами [Co(H2O)6]2+ [Ni(H2O)6] 2 + Как правило, аквакомплексы неустойчивы Аквакомплексы образуются при выделении солей из водных растворов в ви… Важнейшие типы КС AlCl3 ∙ 6H2O ≡ [Al(H2O)6]Cl3 Если лигандами является вода комплексы называются аквакомплексами [Co(H2O)6]2+ [Ni(H2O)6] 2 + Как правило, аквакомплексы неустойчивы Аквакомплексы образуются при выделении солей из водных растворов в ви…](https://fs1.ppt4web.ru/images/3018/65399/640/img13.jpg)
![Амминокомплексы 2. В амминокомплексах лигандами являются молекулы NH3 [Cu(NH3)4]2+ [Ni(NH3)6]2+ ZnSO4 + 2NH3 ∙ H2O = Zn(OH)2↓ + (NH4)2SO4 Zn(OH)2 + 4NH3 = [Zn(NH3)4](OH)2 комплексный гидроксид цинка Комплексные гидроксиды относятся к сильным основаниям Амминокомплексы 2. В амминокомплексах лигандами являются молекулы NH3 [Cu(NH3)4]2+ [Ni(NH3)6]2+ ZnSO4 + 2NH3 ∙ H2O = Zn(OH)2↓ + (NH4)2SO4 Zn(OH)2 + 4NH3 = [Zn(NH3)4](OH)2 комплексный гидроксид цинка Комплексные гидроксиды относятся к сильным основаниям](https://fs1.ppt4web.ru/images/3018/65399/640/img14.jpg)
![Ацидокомплексы 3. В ацидокомплексах лигандами являются анионы различных кислот. К ним относятся цианидные, галогенидные, карбонатные, оксалатные и другие комплексы. Na[Au(CN)2] - безцветный K2[SiF6] H2[SiF6] кремнефтористо- водородная кислота Компле… Ацидокомплексы 3. В ацидокомплексах лигандами являются анионы различных кислот. К ним относятся цианидные, галогенидные, карбонатные, оксалатные и другие комплексы. Na[Au(CN)2] - безцветный K2[SiF6] H2[SiF6] кремнефтористо- водородная кислота Компле…](https://fs1.ppt4web.ru/images/3018/65399/640/img15.jpg)
![Be(OH)2 + 2NaOH = Na2[Be(OH)4] Гидроксокомплексы 4. В гидроксокомплексах лигандами являются ионы ОН- Na3[Al(OH)6] K2[Sn(OH)6] BeCl2 + 2NaOH = Be(OH)2↓ + 2NaCl Гидроксокомплексы образуют металлы, чьи гидроксиды амфотерны Be(OH)2 + 2NaOH = Na2[Be(OH)4] Гидроксокомплексы 4. В гидроксокомплексах лигандами являются ионы ОН- Na3[Al(OH)6] K2[Sn(OH)6] BeCl2 + 2NaOH = Be(OH)2↓ + 2NaCl Гидроксокомплексы образуют металлы, чьи гидроксиды амфотерны](https://fs1.ppt4web.ru/images/3018/65399/640/img16.jpg)
![[Cu(NH3)4]2+ [Cu(en)2]2+ H3N NH3 CuII H3N NH3 CH2— NH2 H2N — CH2 CuII CH2— NH2 H2N — CH2 Правило Чугаева: наиболее устойчивы хелаты с 5–6-членными циклами Хелаты В хелатах комплексообразователь и лиганды образуют замкнутые циклы Хелаты отличаются по… [Cu(NH3)4]2+ [Cu(en)2]2+ H3N NH3 CuII H3N NH3 CH2— NH2 H2N — CH2 CuII CH2— NH2 H2N — CH2 Правило Чугаева: наиболее устойчивы хелаты с 5–6-членными циклами Хелаты В хелатах комплексообразователь и лиганды образуют замкнутые циклы Хелаты отличаются по…](https://fs1.ppt4web.ru/images/3018/65399/640/img17.jpg)
![Природа химической связи в КС [Zn(NH3)4]Cl2 Ионная связь Ковалентная связь ? – Природа химической связи в КС [Zn(NH3)4]Cl2 Ионная связь Ковалентная связь ? –](https://fs1.ppt4web.ru/images/3018/65399/640/img18.jpg)
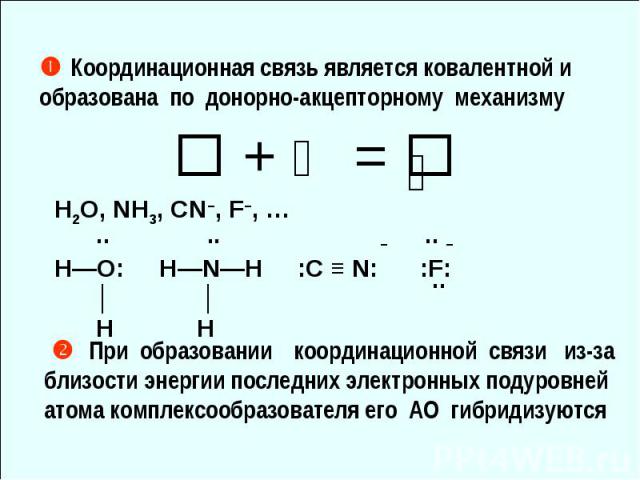
3 Cr0 [Ar] 3d54s1 Cr3+ [Cr(H2O)6]3+ ↑ ↑ ↑ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ↑ ↑ ↑ d2sp3 октаэдр 6 [Cr(H2O)6](NO3)3 - парамагнетик [Cr(H2O)6](NO3)3 Cr0 [Ar] 3d54s1 Cr3+ [Cr(H2O)6]3+ ↑ ↑ ↑ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ↑ ↑ ↑ d2sp3 октаэдр 6 [Cr(H2O)6](NO3)3 - парамагнетик](https://fs1.ppt4web.ru/images/3018/65399/640/img20.jpg)
![K4[Fe(CN)6] Fe0 [Ar] 3d64s2 Fe2+ [Fe(CN)6]4– ⇅ ↑ ↑ ↑ ↑ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ d2sp3 октаэдр K4[Fe(CN)6] - диамагнетик μ = 0 6 K4[Fe(CN)6] Fe0 [Ar] 3d64s2 Fe2+ [Fe(CN)6]4– ⇅ ↑ ↑ ↑ ↑ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ d2sp3 октаэдр K4[Fe(CN)6] - диамагнетик μ = 0 6](https://fs1.ppt4web.ru/images/3018/65399/640/img21.jpg)
![[Ni(NH3)6]Br2 Ni0 [Ar] 3d84s2 Ni2+ ⇅ ⇅ ⇅ ↑ ↑ 3d 4s 4p sp3d2 октаэдр μ > 0 [Ni(NH3)6]2+ … ⇅ ⇅ ⇅ ↑ ↑ 3d 4s 4p 4d ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ 6 [Ni(NH3)6]Br2 Ni0 [Ar] 3d84s2 Ni2+ ⇅ ⇅ ⇅ ↑ ↑ 3d 4s 4p sp3d2 октаэдр μ > 0 [Ni(NH3)6]2+ … ⇅ ⇅ ⇅ ↑ ↑ 3d 4s 4p 4d ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ 6](https://fs1.ppt4web.ru/images/3018/65399/640/img22.jpg)
![Na2[Zn(OH)4] Zn0 [Ar] 3d104s2 Zn2+ [Zn(OH)4]2–Ј ⇅ ⇅ ⇅ ⇅ ⇅ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ sp3 тетраэдр 4 Na2[Zn(OH)4] Zn0 [Ar] 3d104s2 Zn2+ [Zn(OH)4]2–Ј ⇅ ⇅ ⇅ ⇅ ⇅ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ sp3 тетраэдр 4](https://fs1.ppt4web.ru/images/3018/65399/640/img23.jpg)
![K2[Ni(CN)4] Ni0 [Ar] 3d84s2 Ni2+ [Ni(СN)4]2–Ј ⇅ ⇅ ⇅ ↑ ↑ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ dsp2 квадрат μ = 0 4 K2[Ni(CN)4] Ni0 [Ar] 3d84s2 Ni2+ [Ni(СN)4]2–Ј ⇅ ⇅ ⇅ ↑ ↑ 3d 4s 4p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ dsp2 квадрат μ = 0 4](https://fs1.ppt4web.ru/images/3018/65399/640/img24.jpg)
![[Ag(NH3)2]Cl Ag0 [Kr] 4d105s1 Ag+ [Ag(NH3)2]+ ⇅ ⇅ ⇅ ⇅ ⇅ 4d 5s 5p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ sp линейная структура 2 [Ag(NH3)2]Cl Ag0 [Kr] 4d105s1 Ag+ [Ag(NH3)2]+ ⇅ ⇅ ⇅ ⇅ ⇅ 4d 5s 5p ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ ⇅ sp линейная структура 2](https://fs1.ppt4web.ru/images/3018/65399/640/img25.jpg)











