Презентация на тему: Химическая связь. Ионная химическая связь

Химическая связь. Ионная химическая связь

Цель урока: сформировать понятие ионная химическая связь. Задачи урока:Изучить виды химической связи в теме «строение вещества», на данном уроке разобрать причины и механизмы образования ионной связи.Познакомить: с типами ионных кристаллических решеток; с физическими свойствами веществ кристаллических решеток.Знать основные понятия: химическая связь, ионная химическая связь, ионные кристаллические решетки.Уметь определять ионную связь.

Тип урока: изучение нового материала. Этапы урока:Организационный момент: поставить цели и задачи урока.Изучение нового материала.(см. слайды)Закрепление нового материала.

Химическая связь Это взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.4 типа химических связей:ИоннаяКовалентнаяМеталлическаяВодородная

Ионная химическая связь Это связь, образовавшаяся за счет электростатического притяжения катионов к анионам.Главный закон химической реакции - заполнение валентного энергетического уровня. Когда валентный энергетический уровень заполнен - элемент становится стабильным или насыщенным.

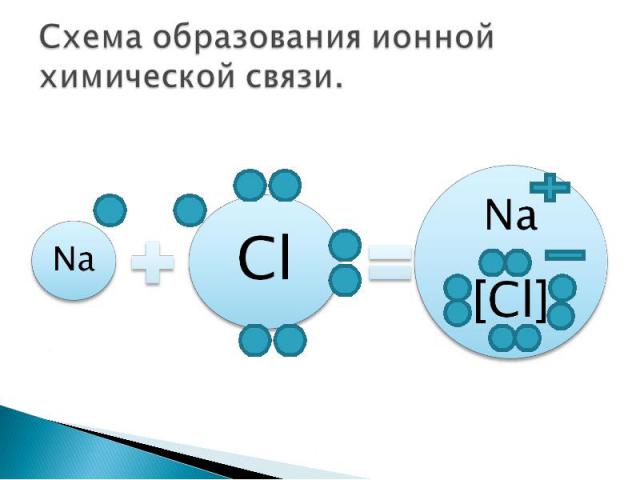
Схема образования ионной связи в хлориде натрия. Натрий - Na, щелочной металл (группа IA). Электронная конфигурация: 1s22s22p63s1 Как видим, натрий имеет один валентный электрон, который он "согласен" отдать, чтобы его энергетические уровни стали завершенными.

Схема образования ионной связи в хлориде натрия. Хлор - Cl, галоген (группа VIIA). Электронная конфигурация: 1s22s22p63s23p5 Как видим, хлор имеет 7 валентных электронов и ему "не хватает" одного электрона, чтобы его энергетические уровни стали завершенными.

почему "дружны" атомы хлора и натрия?
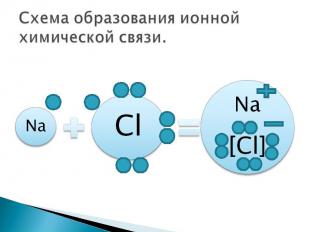
Схема образования ионной химической связи.

Натрий Na На внешнем энергетическом уровне атома натрия находится один электрон. Для перехода в стабильное состояние, натрий должен: отдать этот электрон, у него "исчезает" 3s-орбиталь, а количество протонов (11) будет на один превосходить количество электронов (10). Поэтому, нейтральный атом натрия превратится в положительно заряженный ион - катион. Электронная конфигурация катиона натрия: Na+ 1s22s22p6 Такая же электронная конфигурация и у неона (Ne).

Так что же, натрий превратился в неон? Вовсе нет - не забывайте о протонах! Их по-прежнему; у натрия - 11; у неона - 10. Говорят, что катион натрия является изоэлектронным неону (поскольку их электронные конфигурации одинаковы).

Натрий Na Подведем итог: атом натрия и его катион отличаются одним электроном; катион натрия имеет меньший размер, поскольку он теряет внешний энергетический уровень.

Хлор Cl У хлора ситуация прямо противоположная - на внешнем энергетическом уровне у него находится семь валентных электронов и ему надо принять один электрон, чтобы стать стабильным.

Хлор Cl Подведем итог:атом хлора примет один электрон и станет отрицательно заряженным анионом (17 протонов и 18 электронов); электронная конфигурация хлора: Cl- 1s22s22p63s23p6 анион хлора является изоэлектронным аргону (Ar); поскольку внешний энергетический уровень хлора "достроился", то радиус катиона хлора будет немного больше, чем у "чистого" атома хлора.

В результате перемещения электрона образуются ионы: катион натрия (Na+) и анион хлора (Cl-). Поскольку противоположные заряды притягиваются, то образуется устойчивое соединение NaCl (хлорид натрия) - поваренная соль.

Катионы Другие соли образуются по аналогичному принципу, что и хлорид натрия. Металл отдает электроны, а неметалл их получает. Из периодической таблицы видно, что: элементы группы IA (щелочные металлы) отдают один электрон и образуют катион с зарядом 1+; элементы группы IIA (щелочноземельные металлы) отдают два электрона и образуют катион с зарядом 2+; элементы группы IIIA отдают три электрона и образуют катион с зарядом 3+;

Анионы элементы группы VIIA (галогены) принимают один электрон и образуют анион с зарядом 1-; элементы группы VIA принимают два электрона и образуют анион с зарядом 2-; элементы группы VA принимают три электрона и образуют анион с зарядом 3-;

Пример катионов Li+ Катион лития Na+ Катион натрия K+ Катион калия Be2+ Катион бериллия Mg2+ Катион магния Ca2+ Катион кальция Sr2+ Катион стронция Ba2+ Катион бария

Пример анион ов F- Анион фтораCl- Анион хлораBr- Анион брома I- Анион йода O2- Анион кислорода S2- Анион серы

Ионная кристаллическая решетка

Ионная кристаллическая решетка В кристалле хлорида натрия нельзя выделить отдельные молекулы соли. Их нет. Весь кристалл следует рассматривать как гигантскую макромолекулу, состоящую из равного числа ионов Na+ и Cl-, NanCln, где n - большое число . Связи между ионами в таком кристалле весьма прочны. Поэтому вещества с ионной решеткой обладают сравнительно высокой твердостью. Они тугоплавки и малолетучи.

Ионная кристаллическая решетка Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и уменьшению прочности связи между ними. Поэтому расплавы их проводят электрический ток. Ионные соединения, как правило, легко растворяются в жидкостях, состоящих из полярных молекул, например в воде.

Ионная кристаллическая решетка

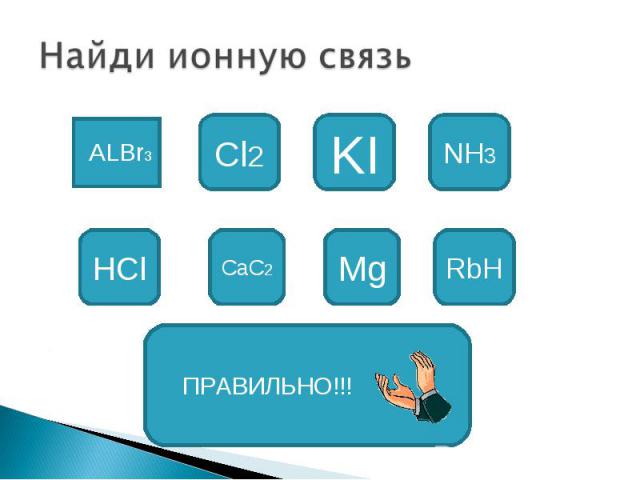
Найди ионную связь

Спасибо за внимание! Презентацию подготовила и провела учитель химии Бойкова А.А.

Литература: Габриелян О.С., Лысова Г.Г. «Учебник химии», 11 класс.www.himhelp.ruwww.prosto-o-slognom.ru/chimia