Презентация на тему: Защита зоны электродуговой сварки от окисления

Кузнецов В.Д МСП-09-Д1

В зоне сварки кислород является наиболее вредной примесью, так как окисляет элементы, которые входят в состав металла шва, и ухудшает его качество, образуя химические соединения — окислы. Окисление элементов, как правило, происходит за счет кислорода, содержащегося в шлаках и газах сварочной зоны. Окисление в меньшей степени может быть вызвано кислородом поверхностных окислов свариваемого металла (ржавчины, окалины). При случайном повышении длины дуги капли электродного металла могут окисляться кислородом окружающего воздуха.Возникновение заряженных частиц в дуговом промежутке обусловливается эмиссией (испусканием) электронов с поверхности отрицательного электрода (катода) и ионизацией находящихся в промежутке газов и паров. Электрическую дугу, используемую для сварки металлов, называют сварочной дугой.

Основными реакциями, происходящими в зоне сварки, являются реакции окисления и раскисления металла. Характерные условия металлургических реакций при сварке, как и при кристаллизации — высокая температура нагрева, относительно малый объем расплавленного металла, кратковременность процесса. Кислород в атомарном состоянии образует с железом закись (FеО), окись (Fе2О3), а также закись-окись (Fе3О4). В жидком металле растворяется только закись железа. Остальные окислы находятся в виде шлаковых включений и всплывают на поверхности сварочной ванны.

Прямое окисление металла свободным кислородом газовой фазы в общем виде может быть представлено реакциями: nМе + 02 = mMe п О 2 где т и п — численные коэффициенты формулы химических реакций; Ме — масса элемента металла; О2 — масса кислорода. Химические реакции протекают до состояния равновесия между исходными веществами и продуктами реакции. О состоянии равновесия можно судить по константе равновесия &. Из закона действующих масс известно, что K=MemO2n/2/(MemOn) где МemО — соответственно содержание вмассе элемента Ме и кислорода в зоне реакции, %. Реакция окисления будет происходить тем интенсивнее, чем больше произведение концентраций, вступающих в реакцию веществ (в данной формуле значение числителя), по сравнению с равновесной. Если константа будет меньше равновесной, идет реакция восстановления металла из его окисла. Константа равновесия, выраженная через парциальное давление пара веществ, вступающих в реакцию,

Поставщиком кислорода в сварочную ванну могут быть окислы, находящиеся на кромках свариваемого металла, на поверхности сварочной проволоки, в сварочном флюсе и покрытии электродов, а также растворяющиеся в металле химически активные шлаки, отдающие кислород металлу в результате обменных окислительно-восстановительных реакций. В железе, в сталях и сплавах на его основе хорошо растворяется только закись железа FeO. Растворенная в жидком металле шва закись железа, оставаясь в затвердевшем шве, ухудшает его свойства. Для удаления растворенного кислорода в металл вводят такие элементы, как Al, Ti, Si, Mn, образующие нерастворимые в жидкой стали окислы А1203, Ti02, Si02, МnО, которые всплывают в шлак. Лишь незначительное количество этих окислов в виде дисперсных частичек остается в металле шва.

Расположив элементы в ряд по мере уменьшения их сродства к кислороду, получим: для температуры 2300° С (стадия капли) — С, Zr, Al, Са, Ti, Mg, В, Mn, V, Si, Cr, Mo, W, Fe, Ni, Си; для температуры ^ 1700° С (в ванне) — Al, Са, Mg, Zr, С, Ti, В, Si, V, Mn, Cr, Mo, Fe, W, Ni, Си; для температуры кристаллизации металла стального шва — Са, Mg, Al, Zr, Ti, В, Si, V, Mn, С, Cr, Mo, Fe, W, Ni, Си. Если в сварочной ванне отсутствуют алюминий, титан и редкоземельные элементы, основными раскислителями являются кремний и марганец. В той или иной степени окисляется хром

Все кривые упругости диссоциации окислов металлов (см. рис. III.7) в рассматриваемом интервале температур расположены выше прямой, отвечающей парциальному давлению кислорода воздуха (например, при сварке незащищенной дугой или в защитной среде с таким же парциальным давлением кислорода). Это означает, что в данных условиях все металлы будут окисляться. Исключение составляют закись никеля и окись меди (см. табл. Ш.З) с упругостью диссоциации при температуре выше 2200° С большей парциального давления кислорода воздуха. Следовательно, при этой и более высоких температурах они будут самопроизвольно восстанавливаться из окисла. Благородные металлы, упругость диссоциации окислов которых значительно более высока, либо не окисляются вовсе (золото, платина), либо окисляются весьма слабо (серебро).
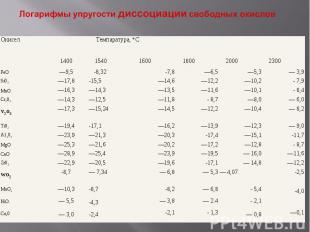
Окисел Темпаратура, *C 1400 1540 1600 1800 2000 2300 FeO —9,5 -8,32 -7,8 —6,5 —5,3 — 3,9 Si02 —17,8 -15,5 —14,6 —12,2 —10,2 - 7,9 MnO —16,3 —14,3 —13,5 —11,6 —10,1 - 8,4 Cr203 —14,3 —12,5 —11,8 - 8,7 —8,0 — 6,0 v2o3 —17,3 —15,24 —14,5 —12,2 —10,4 — 8,2 Ti02 —19,4 -17,1 —16,2 —13,9 —12,3 — 9,0 A1203 —23,9 —21,3 —20,3 -17,4 —15,1 -11,7 MgO —25,3 —21,6 —20,2 —17,2 —12,8 - 8,7 CaO —28,9 —25,4 —23,9 —19,5 — 16,0 —11,6 Zr02 —22,9 —20,5 —19,6 -17,1 — 14,8 —12,2 wo2 -8,7 — 7,34 — 6,8 — 5,3 — 4,07 -2,5 MoOa —10,3 -8,7 -8,2 — 6,8 - 5,4 -4,0 NiO. — 5,5 -4,3 — 3,8 — 2.4 - 2,1 — Cu,0 — 3,0 -2,4 -2,1 - 1,3 — 0,8 —0,1

Из компонентов сварочных шлаков (флюсов и электродных покрытий) закись железа имеет наибольшую упругость диссоциации, являясь наименее устойчивым окислом. Поэтому, чем больше окислов железа содержится в сварочном флюсе или покрытии электродов (например, системы Si02 — А1203 — СаО — MgO — CaF2 — MnO — FeO), тем выше его окислительная способность и тем интенсивнее будут протекать реакции окисления элементов расплавленного и контактирующего со шлаком металла. Расположив элементы в ряд по мере уменьшения их сродства к кислороду, получим: для температуры 2300° С (стадия капли) — С, Zr, Al, Са, Ti, Mg, В, Mn, V, Si, Cr, Mo, W, Fe, Ni, Си; для температуры ^ 1700° С (в ванне) — Al, Са, Mg, Zr, С, Ti, В, Si, V, Mn, Cr, Mo, Fe, W, Ni, Си; для температуры кристаллизации металла стального шва — Са, Mg, Al, Zr, Ti, В, Si, V, Mn, С, Cr, Mo, Fe, W, Ni, Си. Если в сварочной ванне отсутствуют алюминий, титан и редкоземельные элементы, основными раскислителями являются кремний и марганец. В той или иной степени окисляется хром.

При наличии в металле нескольких элементов окисляться будет каждый из них, взаимодействуя с кислородом как газовой фазы, так и окислов элементов с более высокой упругостью диссоциации (например, FeO), причем с интенсивностью и конечным количественным результатом, зависящими не только от сродства этого элемента к кислороду, но и от исходного содержания его в металле. Вводя в металл более сильные раскислители, можно предотвратить либо по крайней мере в некоторой степени уменьшить выгорание того или иного легирующего элемента, необходимого для обеспечения требуемых свойств металла шва.
























