Презентация на тему: Комплексные соединения

КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Муниципальное общеобразовательное учреждение Сусанинская средняя школа Выполнила: учитель химии Обливанова Светлана Викторовна 900igr.net

Соединения, имеющие в своем составе комплексные ионы, относят к комплексным соединениям

Основные положения координационной теории (1893г. Альфред Вернер) 1. В комплексном соединении один из ионов или атомов считается центральным, его называют комплексообразователем. 2. Вокруг центрального иона (атома) – комплексообразователя расположено (координировано) определенное число противоположно заряженных ионов или полярных молекул, называемых лигандами. 3. Центральный ион (атом) с лигандами образует внутреннюю координационную сферу соединения, которую при написании заключают в квадратные скобки. 4. В большинстве случаев число лигандов, непосредственно связанных с центральным ионом (атомом), называется координационным числом, которое чаще всего принимает значения 2,4,6,8. 5. Ионы, которые располагаются на более далеком расстоянии от центрального иона (атома), образуют внешнюю координационную сферу.
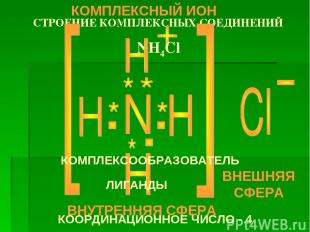
СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ NH4Cl КОМПЛЕКСООБРАЗОВАТЕЛЬ ЛИГАНДЫ КООРДИНАЦИОННОЕ ЧИСЛО - 4 ВНУТРЕННЯЯ СФЕРА ВНЕШНЯЯ СФЕРА КОМПЛЕКСНЫЙ ИОН
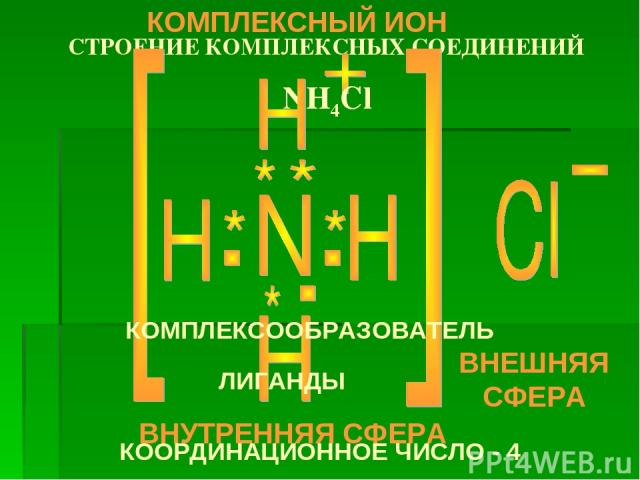
![[N-3H+14]Cl-1 КОМПЛЕКСНЫЙ ИОН [NH4]+ ВНУТРЕННЯЯ СФЕРА: КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3 [N-3H+14]Cl-1 КОМПЛЕКСНЫЙ ИОН [NH4]+ ВНУТРЕННЯЯ СФЕРА: КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3](https://fs3.ppt4web.ru/images/132073/183606/310/img4.jpg)
[N-3H+14]Cl-1 КОМПЛЕКСНЫЙ ИОН [NH4]+ ВНУТРЕННЯЯ СФЕРА: КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3 ЛИГАНДЫ H+ ВНЕШНЯЯ СФЕРА АНИОН Cl-
![(OH)- 4 [Zn+x Na+ (+1) + x + (-1) ] 2 ·2 ·4 = 0 x = 0-2+4 x = +2 Na+[Zn+2(OH)-4] (OH)- 4 [Zn+x Na+ (+1) + x + (-1) ] 2 ·2 ·4 = 0 x = 0-2+4 x = +2 Na+[Zn+2(OH)-4]](https://fs3.ppt4web.ru/images/132073/183606/310/img5.jpg)
(OH)- 4 [Zn+x Na+ (+1) + x + (-1) ] 2 ·2 ·4 = 0 x = 0-2+4 x = +2 Na+[Zn+2(OH)-4]
![РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na3[AlF6] Ответ: Na+3[A РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na3[AlF6] Ответ: Na+3[A](https://fs3.ppt4web.ru/images/132073/183606/310/img6.jpg)
РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na3[AlF6] Ответ: Na+3[Al+3F-6] K[MgCl3] Na[Al(OH)4] Na4[Fe(CN)6] Na3[Al(OH)6] [Cu(NH3)4]Cl2 Ответ: Na+[Al+3(OH)-4] Ответ: K+[Mg+2Cl-3] Ответ:Na+4[Fe+2(CN)-6] Ответ:Na+3[Al+3(OH)-6] Ответ:[Cu+2(NH3)04]Cl-2

НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ 2- 4- 3- 5- 6- ди- три- тетра- пента- гекса- ЧИСЛИТЕЛЬНЫЕ: НАЗВАНИЯ ЛИГАНДОВ: H2O - аква NH3 - амин СO - карбонил OН- - гидроксо- (СN)- - циано F-, Cl-, Br-, I- - фторо-, хлоро-, бромо-, йодо- (NO3)- - нитро

НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ НАЗВАНИЯ АНИОНОВ: Fe - феррат Cu - купрат Ag - аргентат Au - аурат Hg - меркурат Al - алюминат Zn - цинкат
![тетра гидроксо цинкат НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2 4] (OH)- [Zn+2 на тетра гидроксо цинкат НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2 4] (OH)- [Zn+2 на](https://fs3.ppt4web.ru/images/132073/183606/310/img9.jpg)
тетра гидроксо цинкат НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2 4] (OH)- [Zn+2 натрия [Cr+3 (H2O)0 6] Cl-3 хлорид аква гекса xрома (III) K+2 [Hg+2 I- 4] тетра йодо меркурат (II) калия
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na3[AlF6] Na[Al(OH)4] K4[Fe(CN)6] Гексафтороалюм НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na3[AlF6] Na[Al(OH)4] K4[Fe(CN)6] Гексафтороалюм](https://fs3.ppt4web.ru/images/132073/183606/310/img10.jpg)
НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na3[AlF6] Na[Al(OH)4] K4[Fe(CN)6] Гексафтороалюминат натрия Тетрагидроксоалюминат натрия Гексационоферрат (II) калия
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH3)4]SO4 Сульфат тетраамминмеди (II) [Ag(NH НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH3)4]SO4 Сульфат тетраамминмеди (II) [Ag(NH](https://fs3.ppt4web.ru/images/132073/183606/310/img11.jpg)
НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH3)4]SO4 Сульфат тетраамминмеди (II) [Ag(NH3)2]Cl Хлорид диамминсеребра Хлорид гексааквахрома (III) [Cr(H2O)6]Cl3
![Ответ: K2[PtCl6] Гексахлороплатинат (IV) калия Нитрат хлоронитротетраамминкобаль Ответ: K2[PtCl6] Гексахлороплатинат (IV) калия Нитрат хлоронитротетраамминкобаль](https://fs3.ppt4web.ru/images/132073/183606/310/img12.jpg)
Ответ: K2[PtCl6] Гексахлороплатинат (IV) калия Нитрат хлоронитротетраамминкобальта (III) Гексагидроксохромат (III) натрия СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ Ответ: [Co(NH3)4(NO3)Cl]NO3 Ответ: Na3[Cr(OH)6] Нитрат гексаамминникеля (II) Ответ: [Ni(NH3)6](NO3)2

ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Получение тетрагидроксоалюмината натрия AlCl3+3NaOH = Al(OH)3↓+3NaCl Al(OH)3 + NaOH = Na[Al(OH)4] Получение гидроксида тетраамминмеди (II) CuCl2+2NH3 +2H2O = Cu(OH)2↓+NH4Cl Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2
![ХИМИЧЕСКИЕ СВОЙСТВА 1. Диссоциация [Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42- 2. Реакц ХИМИЧЕСКИЕ СВОЙСТВА 1. Диссоциация [Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42- 2. Реакц](https://fs3.ppt4web.ru/images/132073/183606/310/img14.jpg)
ХИМИЧЕСКИЕ СВОЙСТВА 1. Диссоциация [Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42- 2. Реакции по внешней сфере FeCl3+K4[Fe(CN)6]→KFe[Fe(CN)6]↓+3KCl [Cu(NH3)4]SO4+BaCl2→[Cu(NH3)4]Cl2+BaSO4↓ 3. Реакции с участием лигандов [Cu(NH3)4]SO4+4HCl→4NH4Cl+CuSO4 4. Реакции по центральному иону Обменные:[Ag(NH3)2Cl + KI → AgI↓ + KCl + 2NH3 Окислительно-восстановительные: 2[Ag(NH3)2OH+R-C=O →2Ag↓+RCOONH4+H2O+3NH3 H

Применение комплексных соединений в качестве красителей (кобальтовые краски), ядохимикаты, удобрения; для установления жесткости воды; в качестве стимуляторов биохимических процессов; для разделения некоторых металлов (лантаноидов) и получения металлов высокой чистоты; в аналитической химии для определения ионов, например, Fe2+ и Fe3+.

Интересные факты Изучение комплексных соединений – одна из интереснейших областей химии, в том числе биологической химии. Так, красное вещество гем, составная часть гемоглобина крови теплокровных животных и человека – это комплексное соединение: комплексообразователь – ион Fe2+, лиганды – четыре кольца пиррола, имеющие боковые цепи. Похожее строение у хлорофилла, но в нем комплексообразователем служит ион Mg2+.

Рефлексия Составьте формулы: 1.Гесацианоферрат (3) калия, 2. Тетрагидроксоцинкат калия, 3. Гексафторалюминат натрия, 4. Хлорид гексааквахрома (3), 5. Тетрацианомеркурат (2) кальция, 6. Гидроксид диаминсеребра (1)
![Ответы K4[Fe(CN)6] K2[Zn(OH)4] Na3[AlF6] [Cr(H2O)6]Cl3 Ca[Hg(CN)4] [Ag(NH3)2]OH Ответы K4[Fe(CN)6] K2[Zn(OH)4] Na3[AlF6] [Cr(H2O)6]Cl3 Ca[Hg(CN)4] [Ag(NH3)2]OH](https://fs3.ppt4web.ru/images/132073/183606/310/img18.jpg)
Ответы K4[Fe(CN)6] K2[Zn(OH)4] Na3[AlF6] [Cr(H2O)6]Cl3 Ca[Hg(CN)4] [Ag(NH3)2]OH




![[N-3H+14]Cl-1 КОМПЛЕКСНЫЙ ИОН [NH4]+ ВНУТРЕННЯЯ СФЕРА: КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3 ЛИГАНДЫ H+ ВНЕШНЯЯ СФЕРА АНИОН Cl- [N-3H+14]Cl-1 КОМПЛЕКСНЫЙ ИОН [NH4]+ ВНУТРЕННЯЯ СФЕРА: КОМПЛЕКСООБРАЗОВАТЕЛЬ N-3 ЛИГАНДЫ H+ ВНЕШНЯЯ СФЕРА АНИОН Cl-](https://fs3.ppt4web.ru/images/132073/183606/640/img4.jpg)
![(OH)- 4 [Zn+x Na+ (+1) + x + (-1) ] 2 ·2 ·4 = 0 x = 0-2+4 x = +2 Na+[Zn+2(OH)-4] (OH)- 4 [Zn+x Na+ (+1) + x + (-1) ] 2 ·2 ·4 = 0 x = 0-2+4 x = +2 Na+[Zn+2(OH)-4]](https://fs3.ppt4web.ru/images/132073/183606/640/img5.jpg)
![РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na3[AlF6] Ответ: Na+3[Al+3F-6] K[MgCl3] Na[Al(OH)4] Na4[Fe(CN)6] Na3[Al(OH)6] [Cu(NH3)4]Cl2 Ответ: Na+[Al+3(OH)-4] Ответ: K+[Mg+2Cl-3] Ответ:Na+4[Fe+2(CN)-6] Ответ:Na+3[Al+3(OH)-6] Ответ:[Cu+2… РАССТАВЬТЕ СТЕПЕНЬ ОКИСЛЕНИЯ ИОНА КОМПЛЕКСООБРАЗОВАТЕЛЯ: Na3[AlF6] Ответ: Na+3[Al+3F-6] K[MgCl3] Na[Al(OH)4] Na4[Fe(CN)6] Na3[Al(OH)6] [Cu(NH3)4]Cl2 Ответ: Na+[Al+3(OH)-4] Ответ: K+[Mg+2Cl-3] Ответ:Na+4[Fe+2(CN)-6] Ответ:Na+3[Al+3(OH)-6] Ответ:[Cu+2…](https://fs3.ppt4web.ru/images/132073/183606/640/img6.jpg)


![тетра гидроксо цинкат НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2 4] (OH)- [Zn+2 натрия [Cr+3 (H2O)0 6] Cl-3 хлорид аква гекса xрома (III) K+2 [Hg+2 I- 4] тетра йодо меркурат (II) калия тетра гидроксо цинкат НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Na+2 4] (OH)- [Zn+2 натрия [Cr+3 (H2O)0 6] Cl-3 хлорид аква гекса xрома (III) K+2 [Hg+2 I- 4] тетра йодо меркурат (II) калия](https://fs3.ppt4web.ru/images/132073/183606/640/img9.jpg)
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na3[AlF6] Na[Al(OH)4] K4[Fe(CN)6] Гексафтороалюминат натрия Тетрагидроксоалюминат натрия Гексационоферрат (II) калия НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Na3[AlF6] Na[Al(OH)4] K4[Fe(CN)6] Гексафтороалюминат натрия Тетрагидроксоалюминат натрия Гексационоферрат (II) калия](https://fs3.ppt4web.ru/images/132073/183606/640/img10.jpg)
![НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH3)4]SO4 Сульфат тетраамминмеди (II) [Ag(NH3)2]Cl Хлорид диамминсеребра Хлорид гексааквахрома (III) [Cr(H2O)6]Cl3 НАЗОВИТЕ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ [Cu(NH3)4]SO4 Сульфат тетраамминмеди (II) [Ag(NH3)2]Cl Хлорид диамминсеребра Хлорид гексааквахрома (III) [Cr(H2O)6]Cl3](https://fs3.ppt4web.ru/images/132073/183606/640/img11.jpg)
![Ответ: K2[PtCl6] Гексахлороплатинат (IV) калия Нитрат хлоронитротетраамминкобальта (III) Гексагидроксохромат (III) натрия СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ Ответ: [Co(NH3)4(NO3)Cl]NO3 Ответ: Na3[Cr(OH)6] Нитрат гексаамминникеля (II) Ответ: [Ni(NH3)6](NO3)2 Ответ: K2[PtCl6] Гексахлороплатинат (IV) калия Нитрат хлоронитротетраамминкобальта (III) Гексагидроксохромат (III) натрия СОСТАВЬТЕ ФОРМУЛЫ ВЕЩЕСТВ Ответ: [Co(NH3)4(NO3)Cl]NO3 Ответ: Na3[Cr(OH)6] Нитрат гексаамминникеля (II) Ответ: [Ni(NH3)6](NO3)2](https://fs3.ppt4web.ru/images/132073/183606/640/img12.jpg)
![ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Получение тетрагидроксоалюмината натрия AlCl3+3NaOH = Al(OH)3↓+3NaCl Al(OH)3 + NaOH = Na[Al(OH)4] Получение гидроксида тетраамминмеди (II) CuCl2+2NH3 +2H2O = Cu(OH)2↓+NH4Cl Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 ПОЛУЧЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Получение тетрагидроксоалюмината натрия AlCl3+3NaOH = Al(OH)3↓+3NaCl Al(OH)3 + NaOH = Na[Al(OH)4] Получение гидроксида тетраамминмеди (II) CuCl2+2NH3 +2H2O = Cu(OH)2↓+NH4Cl Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2](https://fs3.ppt4web.ru/images/132073/183606/640/img13.jpg)
![ХИМИЧЕСКИЕ СВОЙСТВА 1. Диссоциация [Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42- 2. Реакции по внешней сфере FeCl3+K4[Fe(CN)6]→KFe[Fe(CN)6]↓+3KCl [Cu(NH3)4]SO4+BaCl2→[Cu(NH3)4]Cl2+BaSO4↓ 3. Реакции с участием лигандов [Cu(NH3)4]SO4+4HCl→4NH4Cl+CuSO4 4. Реакц… ХИМИЧЕСКИЕ СВОЙСТВА 1. Диссоциация [Cu(NH3)4]SO4 ↔ [Cu(NH3)4]2+ + SO42- 2. Реакции по внешней сфере FeCl3+K4[Fe(CN)6]→KFe[Fe(CN)6]↓+3KCl [Cu(NH3)4]SO4+BaCl2→[Cu(NH3)4]Cl2+BaSO4↓ 3. Реакции с участием лигандов [Cu(NH3)4]SO4+4HCl→4NH4Cl+CuSO4 4. Реакц…](https://fs3.ppt4web.ru/images/132073/183606/640/img14.jpg)



![Ответы K4[Fe(CN)6] K2[Zn(OH)4] Na3[AlF6] [Cr(H2O)6]Cl3 Ca[Hg(CN)4] [Ag(NH3)2]OH Ответы K4[Fe(CN)6] K2[Zn(OH)4] Na3[AlF6] [Cr(H2O)6]Cl3 Ca[Hg(CN)4] [Ag(NH3)2]OH](https://fs3.ppt4web.ru/images/132073/183606/640/img18.jpg)











