Презентация на тему: Коллоидные системы

* Дисперсная система Дисперсная фаза (раздробленная часть дисперсной системы) Дисперсионная среда (непрерывная часть дисперсной системы) Дисперсные системы – гетерогенные системы, в которых одна из фаз находится в дисперсном (раздробленном состоянии). Поверхностные явления – совокупность явлений, связанных с физическими особенностями границ раздела между соприкасающимися фазами. 900igr.net

* Признаки объектов коллоидной химии

* Поперечный размер частицы (а) – диаметр для сферических частиц (d) и длина ребра для кубических частиц (l). Дисперсность (D) – величина, обратная поперечному размеру частицы: D=1/a. Удельная поверхность (Sуд) – межфазная поверхность, приходящаяся на единицу объема или массы дисперсной фазы: Частицы сферической формы Частицы цилиндрической формы Частицы кубической формы
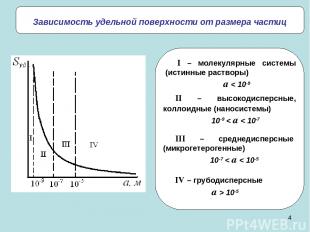
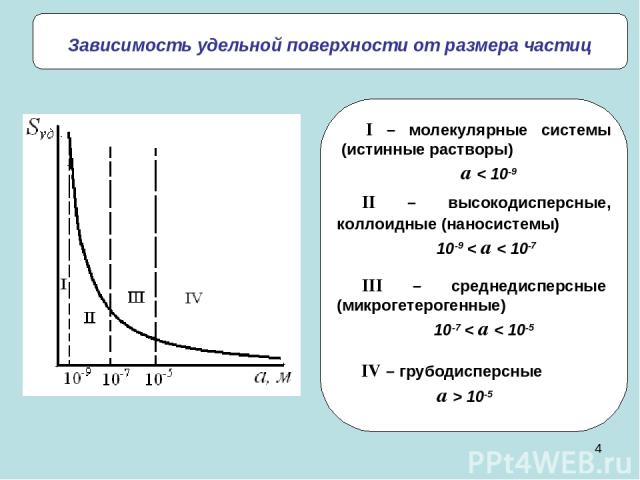
* Зависимость удельной поверхности от размера частиц II – высокодисперсные, коллоидные (наносистемы) 10-9 < a < 10-7 III – среднедисперсные (микрогетерогенные) 10-7 < a < 10-5 IV – грубодисперсные a > 10-5

* Пример: Дисперсность частиц коллоидного золота 108 м-1. Принимая частицы золота в виде кубиков определить, какую поверхность они могут покрыть, если их плотно уложить в один слой. Масса коллоидных частиц золота 1 г. Плотность золота 19,6·103 кг/м3.

* Особенности коллоидных систем 2. Термодинамическая неустойчивость 3. Невоспроизводимость (индивидуальность) 4. Способность к структурообразованию
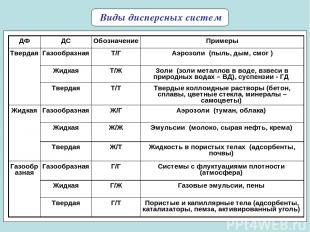
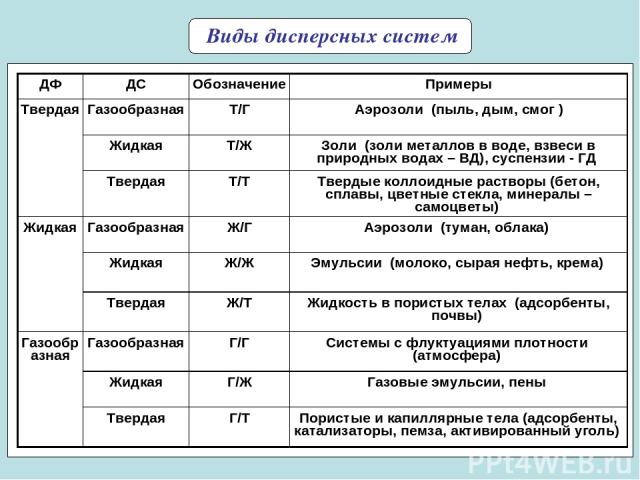
* Виды дисперсных систем ДФ ДС Обозначение Примеры Твердая Газообразная Т/Г Аэрозоли (пыль, дым, смог ) Жидкая Т/Ж Золи (золи металлов в воде, взвеси в природных водах – ВД), суспензии - ГД Твердая Т/Т Твердые коллоидные растворы (бетон, сплавы, цветные стекла, минералы – самоцветы) Жидкая Газообразная Ж/Г Аэрозоли (туман, облака) Жидкая Ж/Ж Эмульсии (молоко, сырая нефть, крема) Твердая Ж/Т Жидкость в пористых телах (адсорбенты, почвы) Газообразная Газообразная Г/Г Системы с флуктуациями плотности (атмосфера) Жидкая Г/Ж Газовые эмульсии, пены Твердая Г/Т Пористые и капиллярные тела (адсорбенты, катализаторы, пемза, активированный уголь)

* Получение дисперсных систем измельчение крупных образцов вещества до частиц дисперсных размеров; химический состав и агрегатное состояние вещества не меняется; затрачивается внешняя работа; используют для получения грубодисперсных систем – производство цемента (1 млрд.т в год), измельчении руд полезных ископаемых, помол муки и т.д.

* Для облегчения диспергирования используют понизители твердости (электролиты, эмульсии, ПАВ и др.) Понизители твердости составляют 0,1 % от общей массы измельчаемых веществ и при этом снижают энергозатраты на получение дисперсных систем более чем в два раза.

* основаны на ассоциации молекул в агрегаты из истинных растворов; используют для получения высокодисперсных систем; не требуют затраты внешней работы; появление новой фазы происходит при пересыщении среды. Конденсационные методы

* Стадии конденсации 2. Рост зародышей. 3. Формирование слоя стабилизатора (ДЭС).

* Физические конденсационные методы

* Химические конденсационные методы

*

* 3. Реакции окисления Образование золя серы. 2H2Sр-р + O2 = 2S ↓+ 2H2O Строение мицеллы:

* 4. Реакции гидролиза Получение золя гидроксида железа. FeCl3 + 3H2O = Fe(OH)3 ↓ + 3HCl Cтроение мицеллы:

* Метод пептизации

* Низкомолекулярные примеси (чужеродные электролиты) разрушают коллоидные системы. Диализ – отделение золей от низкомолекулярных примесей с помощью полупроницаемой мембраны. Электродиализ – диализ, ускоренный внешним электрическим полем. Ультрафильтрация – электродиализ под давлением (гемодиализ). Методы очистки дисперсных систем

* Особенности коллоидных растворов Опалесценция (светорассеяние) наблюдается когда λ > d. Чем короче длина волны падающего света, тем больше рассеяние. 400 нм - синий, 780 нм - красный При боковом свечении дисперсные системы имеют голубоватую окраску (атмосфера Земли), а в проходящем свете – красноватую (восход и закат Солнца). Светомаскировка - синий свет. Сигнализация – красный, оранжевый свет. Окраска драгоценных камней и самоцветов Рубин – коллоидный раствор Cr или Au в Al2O3, Сапфир - коллоидный раствор Ti в Al2O3, Аметист – коллоидный раствор Mn в SiO2.
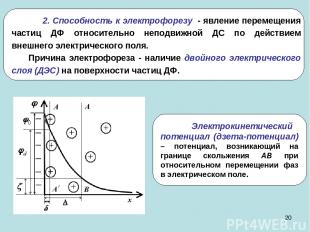
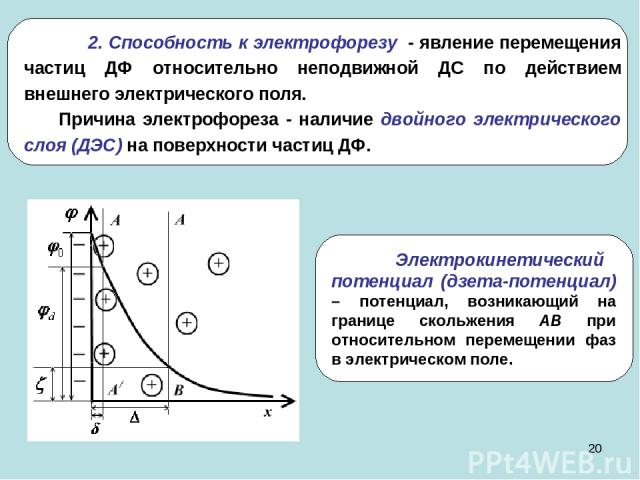
* 2. Способность к электрофорезу - явление перемещения частиц ДФ относительно неподвижной ДС по действием внешнего электрического поля. Причина электрофореза - наличие двойного электрического слоя (ДЭС) на поверхности частиц ДФ.
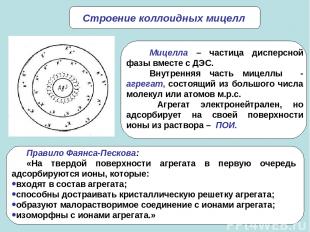
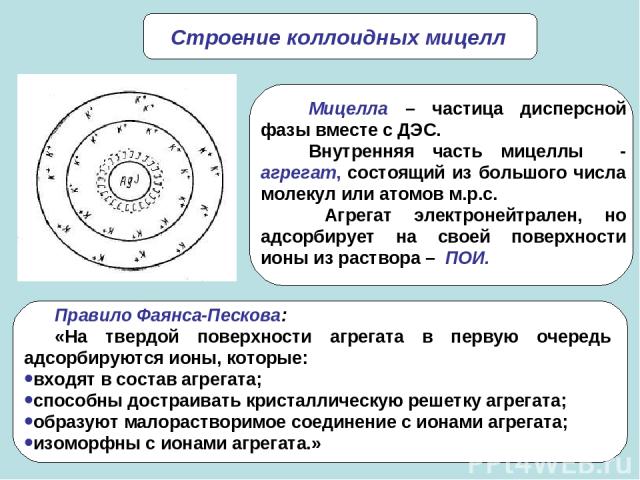
* Строение коллоидных мицелл
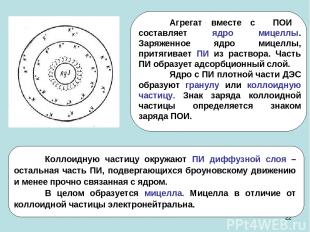
*
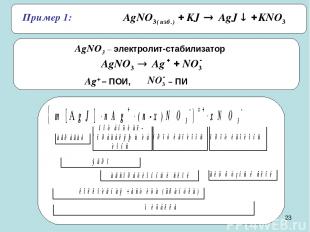
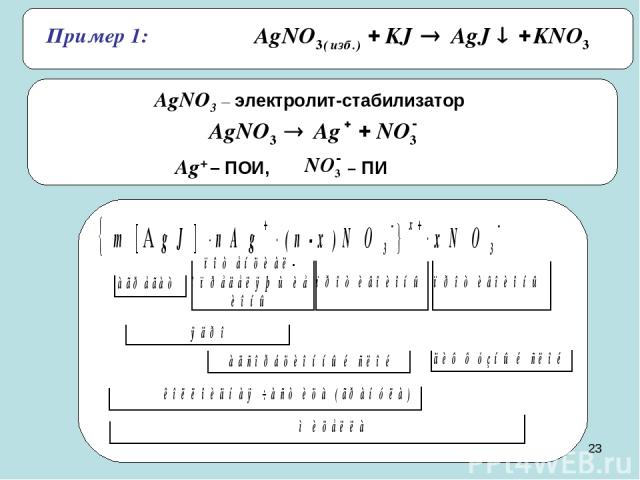
* Пример 1:

* Устойчивость и коагуляция дисперсных систем

* Коагуляция золей электролитами Все электролиты при определенной концентрации могут вызвать коагуляцию золя. Правило знака заряда: коагуляцию золя вызывает тот ион электролита, знак заряда которого противоположен заряду коллоидной частицы. Этот ион называют ионом-коагулятором. Каждый электролит по отношению к коллоидному раствору обладает порогом коагуляции (коагулирующей способностью).

* Порог коагуляции (γ, Скр) – наименьшая концентрация электролита, достаточная для того, чтобы вызвать коагуляцию золя Коагулирующая способность (Р) – величина, обратная порогу коагуляции Влияние заряда иона-коагулятора (правило Шульце-Гарди): коагулирующая способность электролита возрастает с увеличением заряда иона – коагулятора n = 2 ÷ 6

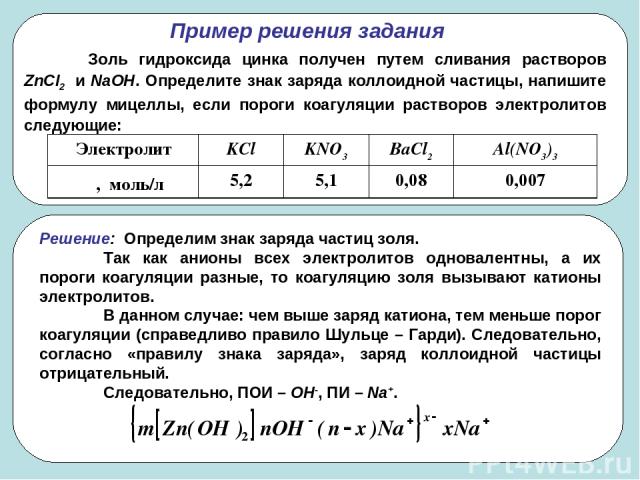
* Пример решения задания Золь гидроксида цинка получен путем сливания растворов ZnCl2 и NaOH. Определите знак заряда коллоидной частицы, напишите формулу мицеллы, если пороги коагуляции растворов электролитов следующие: Электролит KCl KNO3 BaCl2 Al(NO3)3 γ, моль/л 5,2 5,1 0,08 0,007