Презентация на тему: Коллоидная химия

* Е. Е. Бибик Лекции по коллоидной химии Коллоидная химия – наука о дисперсных системах и поверхностных явлениях. 900igr.net

* Пособия Лекции, конспекты практических занятий. Фридрихсберг Д.А. Курс коллоидной химии. Л., «Химия». 1984. 368 с. Сумм Б.Д. Коллоидная химия. 2006. Бибик Е.Е. Сборник задач по коллоидной химии. 2004. 32 с. (№ 1410). Электронные пособия: http://www.lti-gti.ru (далее: факультеты и отделения / хим. отделение / каф. колл. хим./ методические материалы) Пункт III.17 устава института: Оценка может быть выставлена без опроса – по результатам работы студента в течение семестра.
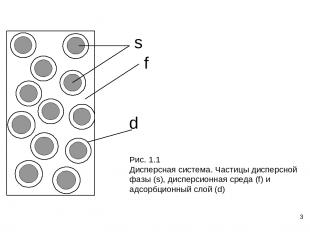
*
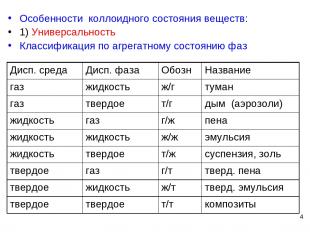
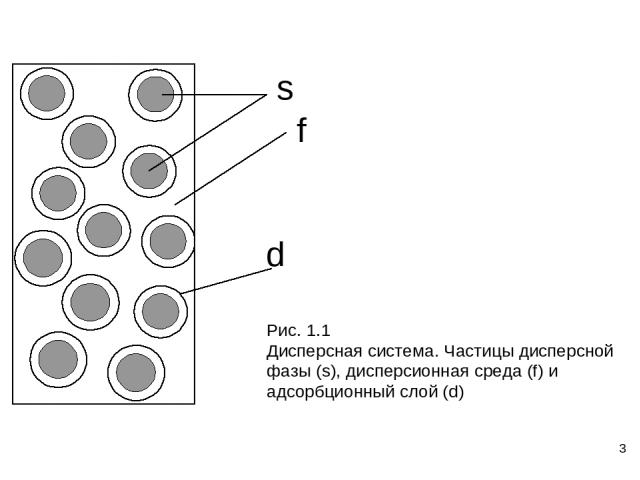
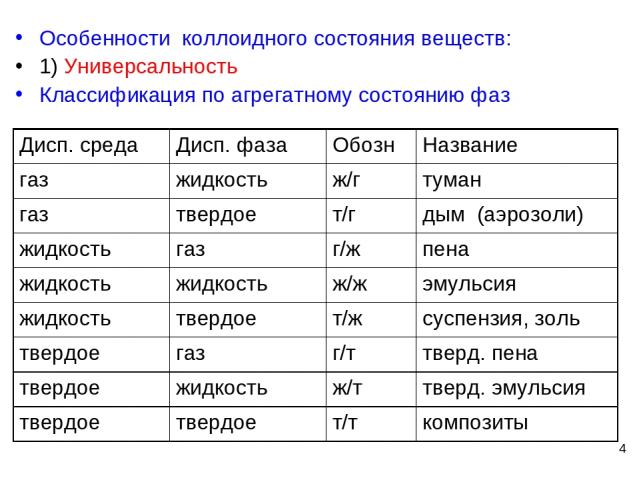
* Особенности коллоидного состояния веществ: 1) Универсальность Классификация по агрегатному состоянию фаз Дисп. среда Дисп. фаза Обозн Название газ жидкость ж/г туман газ твердое т/г дым (аэрозоли) жидкость газ г/ж пена жидкость жидкость ж/ж эмульсия жидкость твердое т/ж суспензия, золь твердое газ г/т тверд. пена твердое жидкость ж/т тверд. эмульсия твердое твердое т/т композиты

* 2) Консерватизм 3)Термодинамическая неустойчивость 4) Геометрические особенности Геометрические характеристики ДС: Размер (радиус) частиц a. Классификация по размеру частиц. Коллоидные растворы (золи) Неоднозначность размера. Полидисперсность, форма. Удельная поверхность дисперсной фазы Aу

* Удельная (на единицу массы) поверхность Aу = s / m , m=vr , s=4p a2 , v=4p a3/3 Aу =3/ar (1.1) Aо=3/a (1.2) 5) Функциональность поверхности. Из числа функций, которые присущи только дисперсным системам, наиболее важной является адсорбция. Технологическое определение – переход компонента из объемных фаз на поверхность. Адсорбция. Технологическое и метрологическое значение
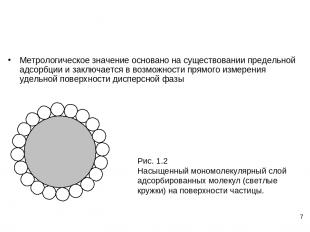
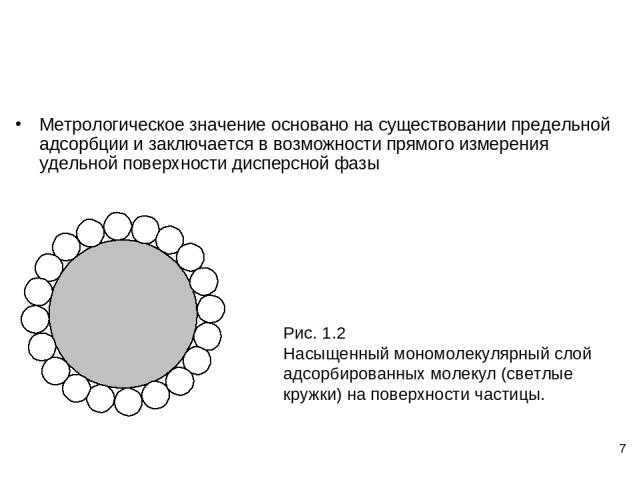
* Метрологическое значение основано на существовании предельной адсорбции и заключается в возможности прямого измерения удельной поверхности дисперсной фазы

* Г – количество адсорбированного вещества (число молей) на единицу площади Гm – предельная адсорбция (рис. 1.2) Гm=1/ s0 NA Xm = Гm Ау Ау=Xm s0 NА (1.4)

* qa = (1-Q ) ka P (1. 5) ka = NA / (2p MRT)1/2 1.2 Адсорбция газов на поверхности твердых тел (теория Ленгмюра)
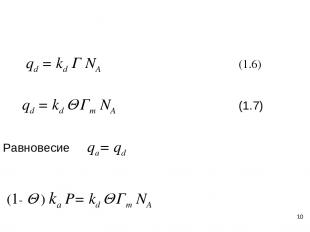
* qd = kd Г NA (1.6) qd = kd Q Гm NA (1.7) Равновесие qa= qd (1- Q ) ka P= kd Q Гm NA

* Q = kaP/(kdNAGm + kaP ) (1.8) k=ka/kdNAGm (1.9) Q = kP/(1+kP) (1.10) G=GmQ. G=GmkP/(1+kP) (1.11) Активные центры
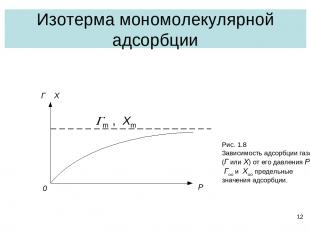
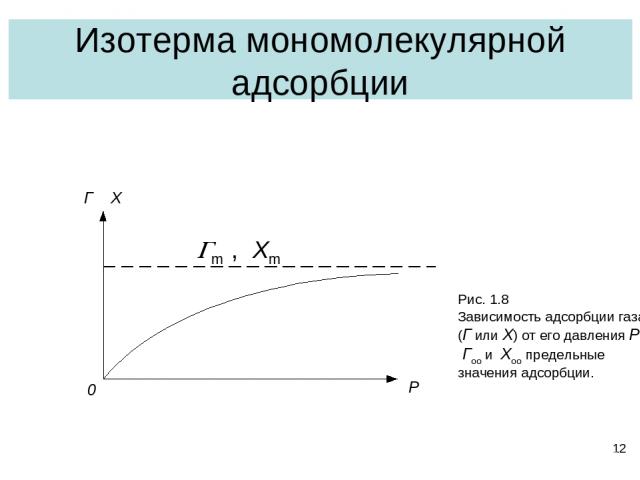
* Изотерма мономолекулярной адсорбции Gm , Xm

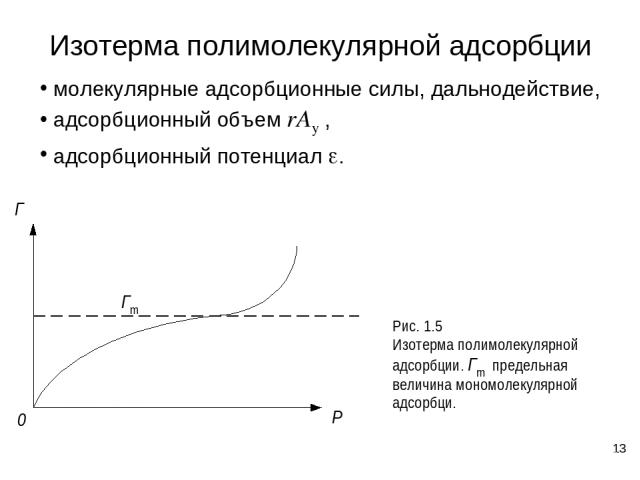
* Изотерма полимолекулярной адсорбции молекулярные адсорбционные силы, дальнодействие, адсорбционный объем rAу , адсорбционный потенциал e.

* Характеристическая кривая e=RT ln(Ps/P) (1.20) График e= f(x)
![* Теория БЭТ G=Gmk(P/Ps)/ [(1-P/Ps)+(k-1)P/Ps] (1.21) * Теория БЭТ G=Gmk(P/Ps)/ [(1-P/Ps)+(k-1)P/Ps] (1.21)](https://fs3.ppt4web.ru/images/132073/183602/310/img14.jpg)
* Теория БЭТ G=Gmk(P/Ps)/ [(1-P/Ps)+(k-1)P/Ps] (1.21)







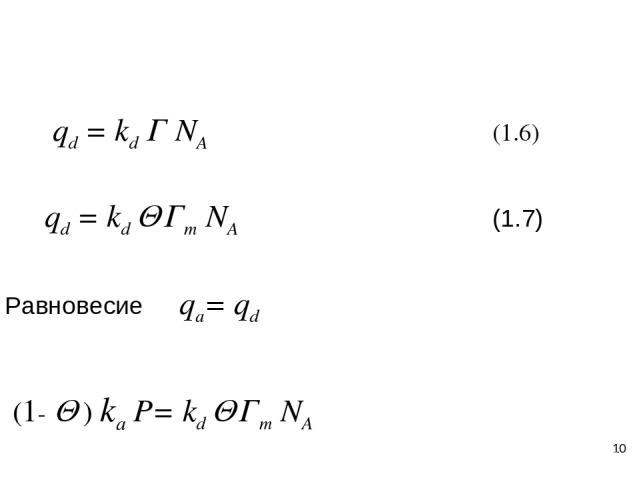


![* Теория БЭТ G=Gmk(P/Ps)/ [(1-P/Ps)+(k-1)P/Ps] (1.21) * Теория БЭТ G=Gmk(P/Ps)/ [(1-P/Ps)+(k-1)P/Ps] (1.21)](https://fs3.ppt4web.ru/images/132073/183602/640/img14.jpg)