Презентация на тему: Химические свойства неметаллов

Общие химические свойства неметаллов Урок в 10 классе 5klass.net

Цель На этом уроке мы поведем разговор о простых веществах – неметаллах, их химических свойствах. Вы должны усвоить общие химические свойства неметаллов и различие в химических свойствах и причины этих различий.

Входной контроль 1. Горящая свеча гаснет в закрытой пробкой банке, потому что: 1) не хватает кислорода 2) повышается температура 3) повышается содержание азота 4) образуется водяной пар, гасящий пламя

Входной контроль 2. В какой из реакций сера проявляет восстановительные свойства свойства 1) S + H2 = H2S 2) S + O2 = SO2 3) S+ Mg = MgS 4) S + C = CS2

Входной контроль 3. Какая из реакций не существует 1) 2KI + CI2 = 2KCI + I2 2) 2NaCI + I2 = 2NaI+ CI2 3) KBr + CI2 = 2KCI + Br2

Входной контроль 4. Уголь реагирует с веществами набора: 1) кислород, угарный газ; 2) кислород, медь; 3) водород, оксид меди; 4) водород, соляная кислота

Входной контроль 5. Азот реагирует: 1) со щелочью; 2) с активными металлами; 3) со фтором; 4) с водой

Ответы: 1 - 1 2 - 2 3 - 2 4 - 3 5 – 2 Проставьте ваше количество баллов в листок самоконтроля.
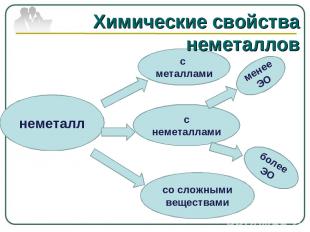
неметалл с металлами с неметаллами со сложными веществами менее ЭО более ЭО Химические свойства неметаллов

Химические свойства неметаллов

Химические свойства неметаллов Проверьте составленные вами уравнения Ca + Cl2 = CaCl2 2Mg + Si = Mg2Si 4Li + O2 = 2Li2O 3Ca + 2P = Ca3P2 2Na + S = Na2S 2Na + H2 = 2NaH

- с менее электротрицательными неметаллами: H2 + S = C + S = P4 + O2 = P + Cl2 = (Пожалуйста допишите уравнения этих реакций. Кто не может сделать сам, можно воспользоваться учебником стр. 226) Химические свойства неметаллов

Химические свойства неметаллов - со сложными веществами: FeCl2 + Cl2 = NaBr + Cl2 = CH4 + O2 = (Пожалуйста допишите уравнения этих реакций. Кто не может сделать сам, можно воспользоваться учебником стр. 226)

Химические свойства неметаллов Неметаллы, как восстановители - реагируют с кислородом и фтором S + F2 = S + O2 = N2 + O2 =

Химические свойства неметаллов реагируют с кислотами окислителями (H2SO4(конц) и HNO3 ) неМе + H2SO4(конц) = к-та(max c.o.) + SO2 + + H2O C + H2SO4(конц) = P + H2SO4(конц) = S + H2SO4(конц) = (Пожалуйста допишите уравнения этих реакций.

Химические свойства неметаллов HNO3 окисляет неМе до соответствующих кислот У HNO3 (конц) азот восстанавливается до NO2 У HNO3 (разб) азот восстанавливается до NO С Si реагирует только HNO3 (разб) (См. реакции на стр.227)

Химические свойства неметаллов для углерода и водорода как восстановителей характерно взаимодействие с оксидами Ме и неМе (См. реакции на стр.228)

Химические свойства неметаллов Реакции диспропорционирования - галогены (кроме фтора) и сера при взаимодействии со щелочами - хлор и бром при взаимодействии с водой (См. реакции на стр.229)

Выходной контроль 1. Простое вещество азот взаимодействует с каждым из веществ группы: а) Н2О, СО2, NaOH б) Mg, HC1, О2 в) Li, H2, О2 г) Сu, H2SO4, H2

Выходной контроль 2. Простое вещество сера взаимодействует с каждым из веществ группы: а) HCl, Na, O2, б) Mg, O2, H2, в) K, Zn, Na2SO4, г) Al, H2O, O2

Выходной контроль 3.Схеме превращения: N+2 → N+4 соответствует химическое уравнение: а) N2 + 3Mg = Mg3N2 б) N2 +3Н2 = 2NH3 в) N2 + О2 = 2NO г) 2NO + О2 = 2NO2

Выходной контроль 4. Запишите химические формулы и названия веществ А и В в схеме превращений: +O2 +H2O P → A → B

Выходной контроль 5. Составьте уравнения реакций по следующей схеме: N2 → NH3 → NH4OH → (NH4 )2SO4 → NH4 Cl → NH3. Укажите условия осуществления реакций.

Д.З. § 34.3 № 4 – 7 стр.241 Спасибо за сотрудничество

Б 2. Серебряную проволоку растворили в азотной кислоте. К полученному раствору добавили избыток гидроксида натрия. Укажите класс веществ, к которому относится выпавший осадок? (ответ напишите в именительном падеже, единственном числе)

Входной контроль 3. Не взаимодействуют между собой диоксид кремния и 1) вода 2) магний 3) оксид калия 4) щелочь

6 (2 балла). Оксид серы (VI) не взаимодействует с веществом, формула которого: А. СО2. Б. Н2О. В. КОН. Г. MgO.

2. Осуществите превращения: SiO2 → Si → Mg2Si → SiH4 → SiO2 → K2SiO3 1. Осуществите превращения и определите степени окисления серы во всех соединениях: Li2S ← S → H2S → SO2 → SO3 → Na2SO4 → BaSO4

1. Осуществите превращения и укажите условия их протекания (где необходимо): С→ СН4 → С2Н2 → СО2 → К2СО3 → СаСО3 → СаНСО3 → СаСО3

12.Оксид углерода (IV) реагирует с обоими веществами группы а) сульфатом калия и гидроксидом натрия б) фосфорной кислотой и водородом в) кислородом и оксидом серы (IV) г) водой и оксидом кальция