Презентация на тему: Химические свойства воды

Аномальные свойства воды МОУ общеобразовательная средняя школа № 5 г. Искитима Новосибирской области Искитим, 2005 Выполнила работу ученица 10 «А» класса Паршина Олеся 900igr.net

Доказать уникальность воды, как химического вещества. Выяснить причины уникальности воды как химического соединения. Теоретический (анализ статей, публикаций.) Ознакомиться со строением молекулы воды. Выяснить влияние водородных связей на физические свойства воды.

Физические свойства воды обусловлены особенностями её строения Обычна ли обычная вода?

Океан, покрывающий почти всю нашу планету, на котором миллион лет назад зародилась жизнь – это вода. Тучи, облака,туманы, роса, несущие влагу всему живому на земной поверхности, -- это тоже вода. Бескрайние ледяные пустыни полярных областей, снеговые покровы, застилающие почти половину планеты, -- и это вода. Вода – самое распространенное неорганическое соединение на нашей планете.

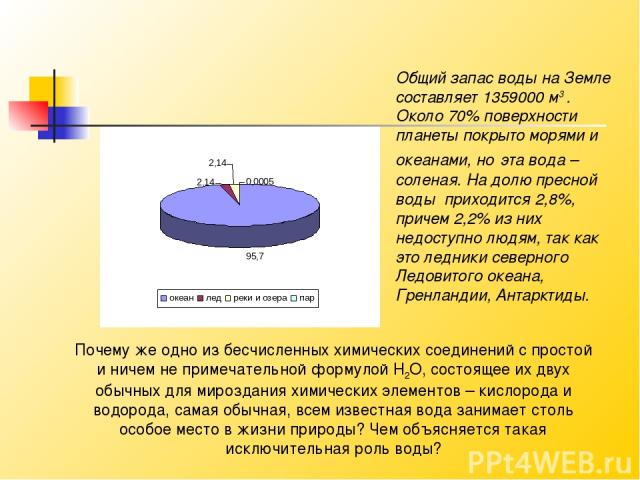
Общий запас воды на Земле составляет 1359000 м3 . Около 70% поверхности планеты покрыто морями и океанами, но эта вода – соленая. На долю пресной воды приходится 2,8%, причем 2,2% из них недоступно людям, так как это ледники северного Ледовитого океана, Гренландии, Антарктиды. Почему же одно из бесчисленных химических соединений с простой и ничем не примечательной формулой Н2О, состоящее их двух обычных для мироздания химических элементов – кислорода и водорода, самая обычная, всем известная вода занимает столь особое место в жизни природы? Чем объясняется такая исключительная роль воды?

Оказывается, почти все физико-химические свойства воды – исключения в природе. Вода – действительно, самое удивительное вещество на планете. Чистая вода – прозрачная жидкость, не имеющая цвета, вкуса и запаха. Но в толстых слоях вода имеет голубоватую окраску, потому что задерживает красную часть спектра световых лучей сильнее, чем синюю (синюю – отражает).

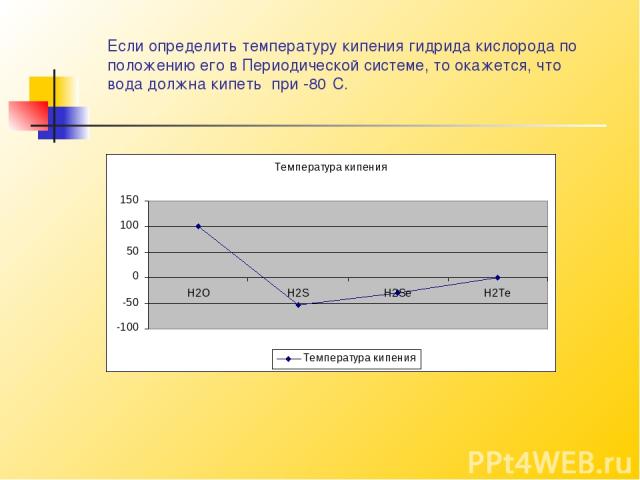
Вода имеет высокие температуры плавления и кипения.Вода кипит при 100⁰ С.Температуры кипения различных веществ не случайны. Сравним между собой одинаковые по составу химические соединения различных элементов,принадлежащих к одной и той же группе Периодической системы химических элементов Менделеева. Легко заметить, что чем меньше атомная масса элемента, тем ниже температура кипения его соединений.
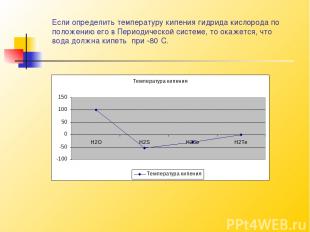
Если определить температуру кипения гидрида кислорода по положению его в Периодической системе, то окажется, что вода должна кипеть при -80⁰С.

Следовательно, вода кипит приблизительно на 180⁰ С выше, чем должна кипеть. Температура воды – это наиболее обычное её свойство оказывается необычайным. Если бы температура кипения воды была -80⁰ С, чтобы тогда случилось на нашей Земле? Океаны внезапно закипели бы. На Земле не осталось бы ни одной капли, и на небе никогда не смогло бы появиться ни одного облачка.

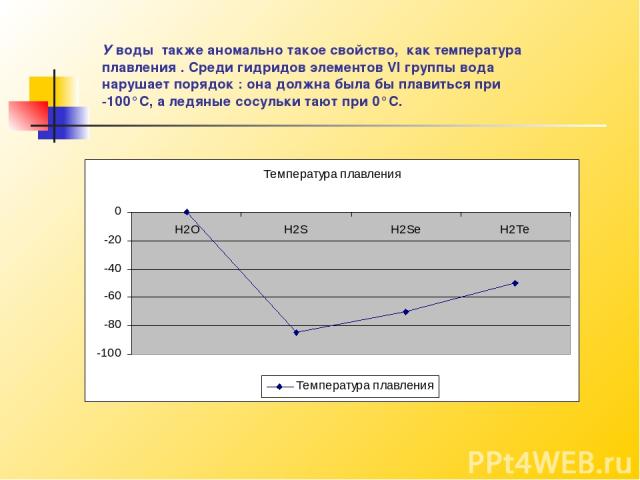
У воды также аномально такое свойство, как температура плавления . Среди гидридов элементов VI группы вода нарушает порядок : она должна была бы плавиться при -100°С, а ледяные сосульки тают при 0°С.

Жидкая вода имеет самую высокую теплоёмкость среди всех жидкостей – 4,19 кДж/кг*град. Вода очень сильно поглощает невидимые инфракрасные(тепловые) лучи, что имеет важное значение для температурного режима нашей планеты. Аномально и изменение плотности воды. Плотность других жидкостей, как правило, постепенно возрастает при понижении температуры. А вода при охлаждении до 0°С, в отличие от других жидкостей, расширяется. Лед легче воды (⍴=0,92 г/см³). Поэтому лед плавает на поверхности.

Зимой, незамерзающий сверху более плотный лед тонул бы в воде, непрерывно опускаясь на дно водоема. Летом лед, защищенный толщей холодной воды, не мог бы растаять. Постепенно все озера, пруды, реки промерзли бы нацело, превратившись в гигантские ледяные глыбы. Наконец, промерзли бы моря, а за ними и океаны. Наш прекрасный цветущий мир стал бы сплошной ледяной пустыней, кое-где покрытый тонким слоем талой воды. Попробуем вообразить, как выглядел бы мир, если бы вода обладала нормальными свойствами

Еще одно свойство, отличающее воду от других жидкостей – это поверхностное натяжение. У подавляющего большинства жидкостей эта величина составляет 20-30 Н/м и только у воды – 72,75 Н/м. Природа в полной мере использовала эту аномалию воды. Влага поднимается от корней к верхушкам высоких деревьев. В растениях природа подъема воды капиллярная. Известно, что если опустить в жидкость капилляр, то жидкость в нём поднимается. Подъем этот будет тем больше, чем меньше диаметр капилляра и чем выше поверхностное натяжение жидкости.

Необычайные свойства воды проистекают от строения её молекулы. Молекула воды имеет угловую структуру. Между молекулами воды образуются водородные связи. Водородной связью называется тип химической связи, который образуется между атомами водорода одной молекулы и атомом электроотрицательного элемента (O,N,F) другой молекулы.

Вода обладает аномальными свойствами: Высокие температуры кипения и плавления Самая высокая теплоёмкость среди жидкостей Лёд легче воды (при охлаждении она расширяется) Высокое поверхностное натяжение 2. Причиной многих аномалий воды являются водородные связи.

Н.В. Медведева, О. В. Сидорова, Л. В. Трубачева «Практикум по экологической химии»,Удмурдский государственный университет, Ижевск, 1999. «Я познаю мир» Детская энциклопедия, Химия/Автор-составитель Л. А. Савина, Москва, АСТ,1996 О. В. Недогибченко «Химические стихи и сказки», НГПУ, НИПКиПРО, Новосибирск,2002 В. В. Синюков «Вода известная и неизвестная», Москва, Знание, 1987 К. С. Лосев «Вода», Ленинград, 1989