Презентация на тему: Химические реакции практическая работа

Практическая работа №1 Признаки химических реакций 900igr.net

ЛСМ к практической работе Цель работы Оборудование Реактивы Правила ТБ Гуманитарный фон (Практическое применение знаний) Уравнения реакций Наблюдения Выводы Алгоритм работы

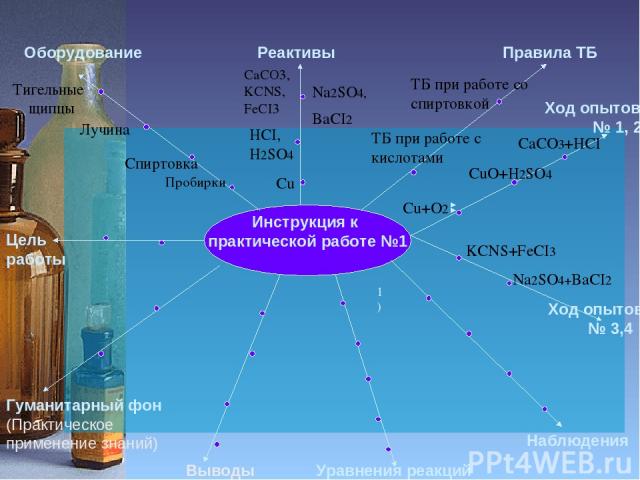
Инструкция к практической работе №1 Цель работы Оборудование Реактивы Правила ТБ Гуманитарный фон (Практическое применение знаний) Уравнения реакций Наблюдения Ход опытов № 1, 2 Пробирки Спиртовка Лучина Тигельные щипцы Cu HCI, H2SO4 CaCO3, KCNS, FeCI3 Na2SO4, BaCI2 ТБ при работе со спиртовкой ТБ при работе с кислотами Выводы Ход опытов № 3,4 Cu+O2 CaCO3+HCI CuO+H2SO4 KCNS+FeCI3 Na2SO4+BaCI2 1)

Практическая работа №1 Цель работы Оборудование Реактивы Правила ТБ Гуманитарный фон (Практическое применение знаний) Уравнения реакций Наблюдения Ход опытов № 1, 2 Исследовать признаки химических реакций Пробирки Спиртовка Провести эксперимент Лучина Тигельные щипцы Cu HCI, H2SO4 CaCO3, KCNS, FeCI3 Na2SO4, BaCI2 ТБ при работе со спиртовкой ТБ при работе с кислотами Выводы Ход опытов №3, 4 Cu+O2 CaCO3+HCI CuO+H2SO4 KCNS+FeCI3 Na2SO4+BaCI2 1) 1)Проволока чернеет, при t образуется голубой раствор 2) Выделяется газ, лучина тухнет 3)Образуется красно-бурый раствор 4)Выпадает белый осадок 2Cu+O2=2CuO соединение CuO+H2SO4=CuSO4+H2O обмен CaCO3+2HCI=CaCI2+CO2 +H2O обмен 3KCNS+FeCI3=3KCI+Fe(CNS)3 обмен Na2SO4+BaCI2=2NaCI+BaSO4 Изменение цвета Выделение газа Выпадение осадка Наблюдали признаки химических реакций 1)CO2 –газ, не поддерживает горение 2) О химическом явлении можно судить по признакам реакции

Практическая работа №2 Получение водорода и определение его свойств

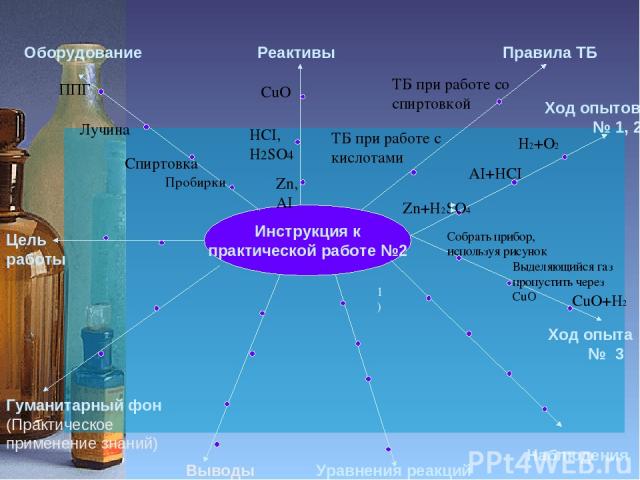
Инструкция к практической работе №2 Цель работы Оборудование Реактивы Правила ТБ Гуманитарный фон (Практическое применение знаний) Уравнения реакций Наблюдения Ход опытов № 1, 2 Пробирки Спиртовка Лучина ППГ Zn, АI HCI, H2SO4 CuO ТБ при работе со спиртовкой ТБ при работе с кислотами Выводы Ход опыта № 3 Zn+H2SO4 H2+O2 AI+HCI Собрать прибор, используя рисунок Выделяющийся газ пропустить через CuO 1) CuO+H2
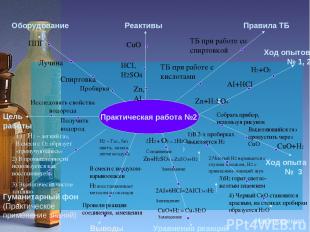
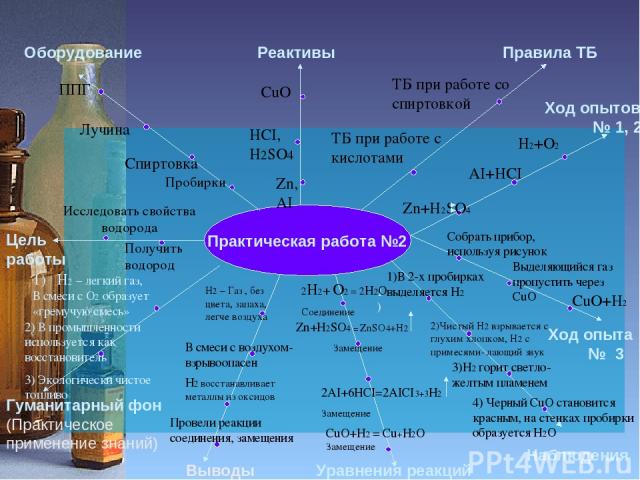
Практическая работа №2 Цель работы Оборудование Реактивы Правила ТБ Гуманитарный фон (Практическое применение знаний) Уравнения реакций Наблюдения Ход опытов № 1, 2 Исследовать свойства водорода Пробирки Спиртовка Получить водород Лучина ППГ Zn, АI HCI, H2SO4 CuO ТБ при работе со спиртовкой ТБ при работе с кислотами Выводы Ход опыта № 3 Zn+H2SO4 H2+O2 AI+HCI Собрать прибор, используя рисунок Выделяющийся газ пропустить через CuO 1) 1)В 2-х пробирках выделяется Н2 2)Чистый Н2 взрывается с глухим хлопком, Н2 с примесями- лающий звук 3)Н2 горит светло-желтым пламенем 4) Черный CuO становится красным, на стенках пробирки образуется H2O Zn+H2SO4 = ZnSO4+H2 Замещение CuO+H2 = Cu+H2O Замещение 2AI+6HCI=2AICI3+3H2 Замещение Н2 – Газ , без цвета, запаха, легче воздуха В смеси с воздухом- взрывоопасен Н2 восстанавливает металлы из оксидов Провели реакции соединения, замещения H2 – легкий газ, В смеси с О2 образует «гремучую смесь» 2) В промышленности используется как восстановитель 3) Экологически чистое топливо CuO+H2 2H2+ O2 = 2H2O Соединение

Практическая работа №3 Получение и свойства кислорода
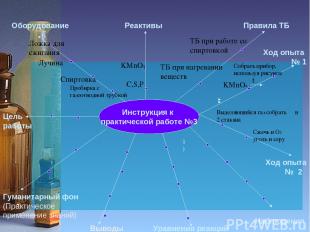
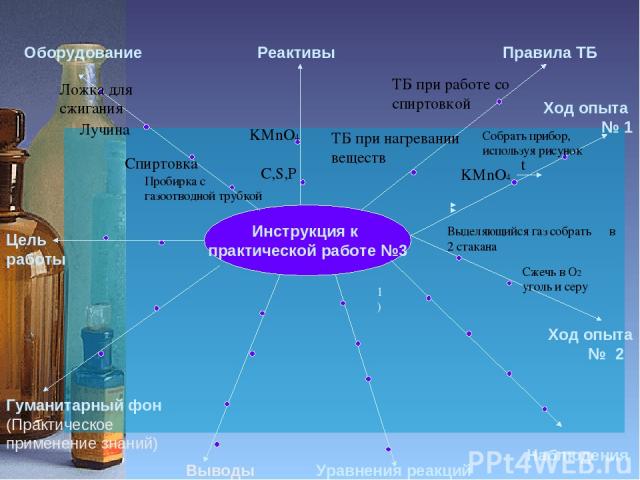
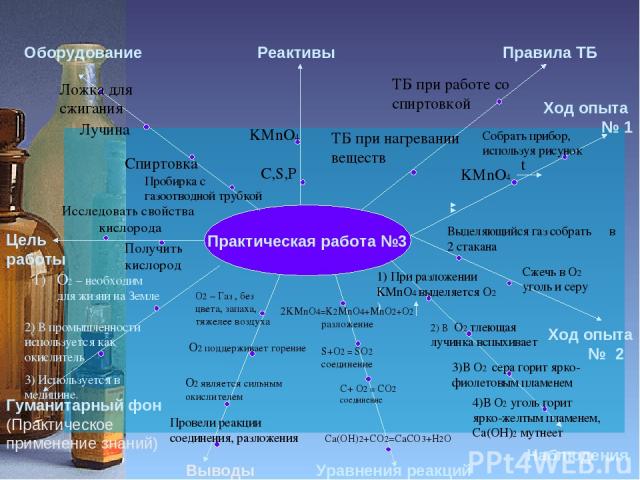
Инструкция к практической работе №3 Цель работы Оборудование Реактивы Правила ТБ Гуманитарный фон (Практическое применение знаний) Уравнения реакций Наблюдения Ход опыта № 1 Пробирка с газоотводной трубкой Спиртовка Лучина Ложка для сжигания C,S,P KMnO4 ТБ при работе со спиртовкой ТБ при нагревании веществ Выводы Ход опыта № 2 Собрать прибор, используя рисунок Выделяющийся газ собрать в 2 стакана 1) KMnO4 t Сжечь в О2 уголь и серу
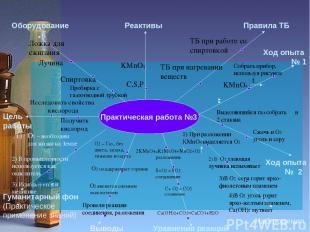
Практическая работа №3 Цель работы Оборудование Реактивы Правила ТБ Гуманитарный фон (Практическое применение знаний) Уравнения реакций Наблюдения Ход опыта № 1 Исследовать свойства кислорода Пробирка с газоотводной трубкой Спиртовка Получить кислород Лучина Ложка для сжигания C,S,P KMnO4 ТБ при работе со спиртовкой ТБ при нагревании веществ Выводы Ход опыта № 2 Собрать прибор, используя рисунок Выделяющийся газ собрать в 2 стакана 1) 1) При разложении KMnO4 выделяется O2 2) В O2 тлеющая лучинка вспыхивает 3)В О2 сера горит ярко-фиолетовым пламенем 4)В О2 уголь горит ярко-желтым пламенем, Ca(OH)2 мутнеет O2 – Газ , без цвета, запаха, тяжелее воздуха О2 поддерживает горение О2 является сильным окислителем Провели реакции соединения, разложения О2 – необходим для жизни на Земле 2) В промышленности используется как окислитель 3) Используется в медицине. KMnO4 t Сжечь в О2 уголь и серу 2KMnO4=K2MnO4+MnO2+O2 разложение S+O2 = SO2 соединение С+ O2 = CO2 соединение Сa(OH)2+CO2=CaCO3+H2O

Практическая работа №4 Условия протекания химических реакций
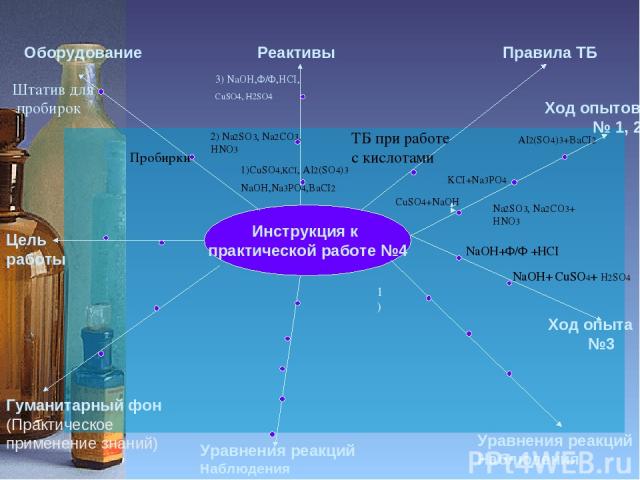
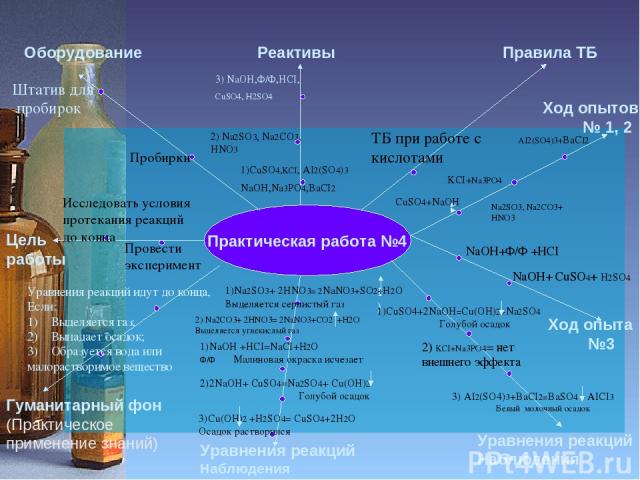
Инструкция к практической работе №4 Цель работы Оборудование Реактивы Правила ТБ Гуманитарный фон (Практическое применение знаний) Уравнения реакций Наблюдения Уравнения реакций Наблюдения Ход опытов № 1, 2 Пробирки Штатив для пробирок 1)CuSO4,KCI, AI2(SO4)3 NaOH,Na3PO4,BaCI2 2) Na2SO3, Na2CO3, HNO3 ТБ при работе с кислотами Ход опыта №3 AI2(SO4)3+BaCI2 KCI+Na3PO4 NaOH+Ф/Ф +HCI NaOH+ CuSO4+ H2SO4 1) 3) NaOH,Ф/Ф,HCI, CuSO4, H2SO4 CuSO4+NaOH Na2SO3, Na2CO3+ HNO3

Практическая работа №4 Цель работы Оборудование Реактивы Правила ТБ Гуманитарный фон (Практическое применение знаний) Уравнения реакций Наблюдения Уравнения реакций Наблюдения Ход опытов № 1, 2 Исследовать условия протекания реакций до конца Пробирки Провести эксперимент Штатив для пробирок 1)CuSO4,KCI, AI2(SO4)3 NaOH,Na3PO4,BaCI2 2) Na2SO3, Na2CO3, HNO3 ТБ при работе с кислотами Ход опыта №3 AI2(SO4)3+BaCI2 KCI+Na3PO4 NaOH+Ф/Ф +HCI NaOH+ CuSO4+ H2SO4 1) 1)CuSO4+2NaOH=Cu(OH)2+Na2SO4 Голубой осадок 2) KCI+Na3PO4= нет внешнего эффекта 3) AI2(SO4)3+BaCI2=BaSO4 + AICI3 Белый молочный осадок 2) Na2СO3+ 2HNO3= 2NaNO3+СO2 +H2O Выделяется углекислый газ 3) NaOH,Ф/Ф,HCI, CuSO4, H2SO4 CuSO4+NaOH Na2SO3, Na2CO3+ HNO3 1)Na2SO3+ 2HNO3= 2NaNO3+SO2+H2O Выделяется сернистый газ 1)NaOH +HCI=NaCI+H2O Ф/Ф Малиновая окраска исчезает 2)2NaOH+ CuSO4=Na2SO4+ Cu(OH)2 Голубой осадок 3)Cu(OH)2 +H2SO4= CuSO4+2H2O Осадок растворился Уравнения реакций идут до конца, Если: Выделяется газ; Выпадает осадок; Образуется вода или малорастворимое вещество

Практическая работа №5 Свойства кислот, оснований, оксидов
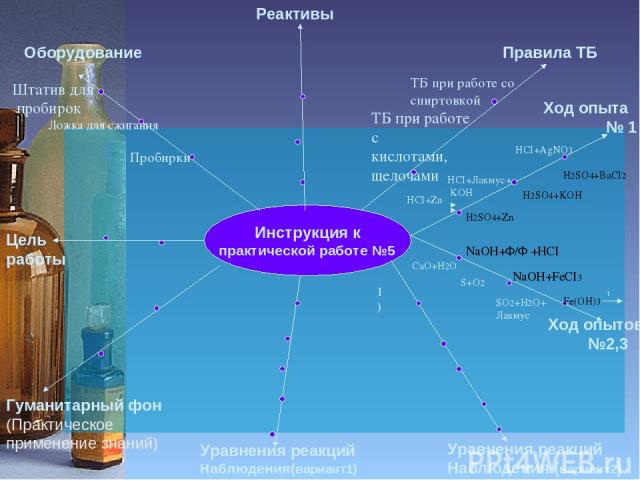
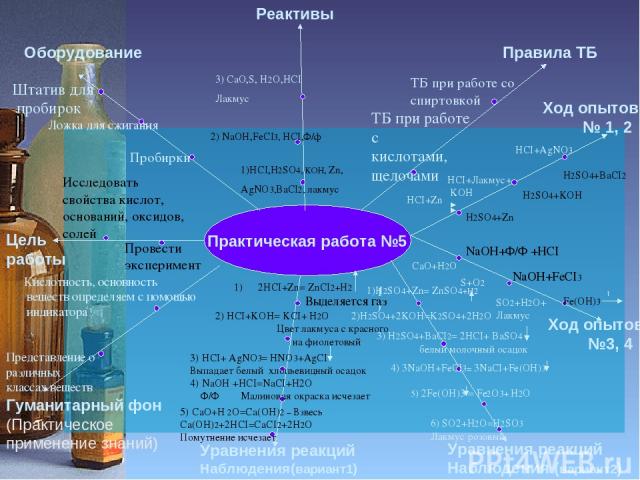
Инструкция к практической работе №5 Цель работы Оборудование Реактивы Правила ТБ Гуманитарный фон (Практическое применение знаний) Уравнения реакций Наблюдения(вариант1) Уравнения реакций Наблюдения (вариант2) Ход опыта № 1 Пробирки Штатив для пробирок ТБ при работе со спиртовкой ТБ при работе с кислотами, щелочами Ход опытов №2,3 HCI+AgNO3 HCI+Лакмус+ KOH NaOH+Ф/Ф +HCI NaOH+FeCI3 1) Ложка для сжигания HCI+Zn H2SO4+Zn H2SO4+KOH H2SO4+BaCI2 Fe(OH)3 t CaO+H2O S+O2 SO2+H2O+ Лакмус

Практическая работа №5 Цель работы Оборудование Реактивы Правила ТБ Гуманитарный фон (Практическое применение знаний) Уравнения реакций Наблюдения(вариант1) Уравнения реакций Наблюдения (вариант2) Ход опытов № 1, 2 Исследовать свойства кислот, оснований, оксидов, солей Пробирки Провести эксперимент Штатив для пробирок 1)HCI,H2SO4, KOH, Zn, AgNO3,BaCI2, лакмус 2) NaOH,FeCI3, HCI,Ф/ф ТБ при работе со спиртовкой ТБ при работе с кислотами, щелочами Ход опытов №3, 4 HCI+AgNO3 HCI+Лакмус+ KOH NaOH+Ф/Ф +HCI NaOH+FeCI3 1) 3) CaO,S, H2O,HCI Лакмус Ложка для сжигания HCI+Zn H2SO4+Zn H2SO4+KOH H2SO4+BaCI2 Fe(OH)3 t CaO+H2O S+O2 SO2+H2O+ Лакмус 2HCI+Zn= ZnCI2+H2 Выделяется газ 2) HCI+KOH= KCI+ H2O Цвет лакмуса с красного на фиолетовый 3) HCI+ AgNO3= HNO3+AgCI Выпадает белый хлопьевидный осадок 4) NaOH +HCI=NaCI+H2O Ф/Ф Малиновая окраска исчезает 5) CaO+H 2O=Ca(OH)2 – Взвесь Ca(OH)2+2HCI=CaCI2+2H2O Помутнение исчезает 1)H2SO4+Zn= ZnSO4+H2 2)H2SO4+2KOH=K2SO4+2H2O 3) H2SO4+BaCI2= 2HCI+ BaSO4 белый молочный осадок 4) 3NaOH+FeCI3= 3NaCI+Fe(OH)3 5) 2Fe(OH)3 = Fe2O3+ H2O 6) SO2+H2O=H2SO3 Лакмус розовый Кислотность, основность веществ определяем с помощью индикатора Представление о различных классах веществ