Презентация на тему: Окислительно-восстановительные реакции.Электролиз

Окислительно-восстановительные реакции.Электролиз.

Окислительно-восстановительными называют реакции, протекающие с изменением степеней окисления элементов, образующих вещества, участвующие в реакции. Степенью окисления называют условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что оно состоит только из простых ионов.

Для того чтобы рассчитать степень окисления, нужно воспользоваться несложными правилами:

Реакция алюминотермии


Окислительно-восстановительная реакция горения метана:


Наиболее сильными восстановителями являются металлы, водород, оксид углерода (II), углерод, сероводород, аммиак и др. Наиболее сильными окислителями являются фтор, кислород, озон, галогены, азотная и серная кислоты, перманганат калия и др. Однако самым сильным из известных окислителей и восстановителей является электрический ток. Он восстанавливает даже щелочные и щелочноземельные металлы и алюминий из их соединений и окисляет даже ионы галогенов и кислорода из их соединений до простых веществ.

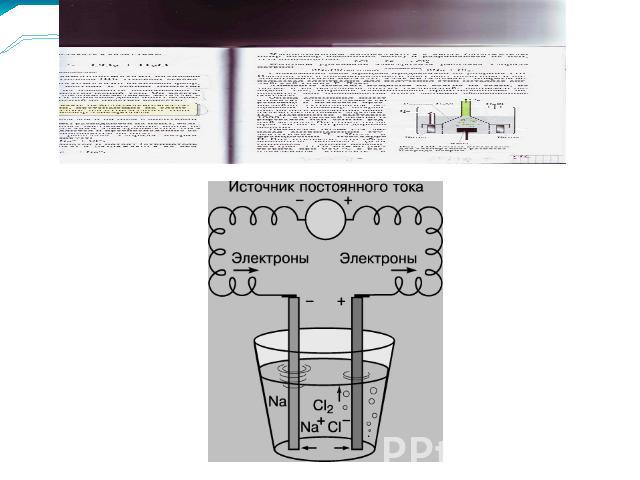
Электролиз Электролизом называют окислительно-восстановительные реакции, протекающие на электродах при прохождении электрического тока через расплав или раствор электролита.
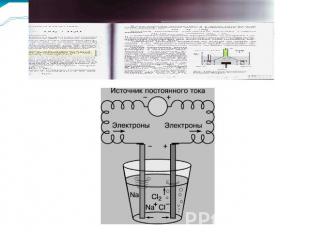

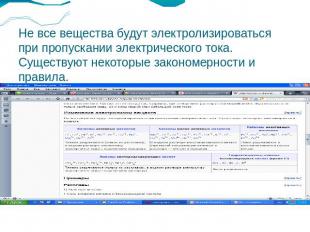
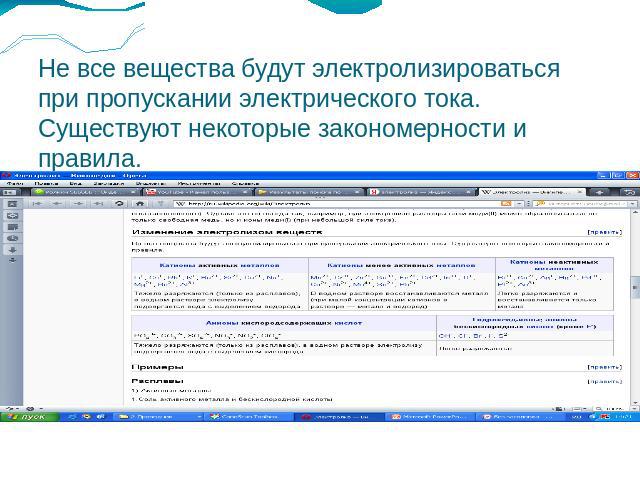
Не все вещества будут электролизироваться при пропускании электрического тока. Существуют некоторые закономерности и правила.
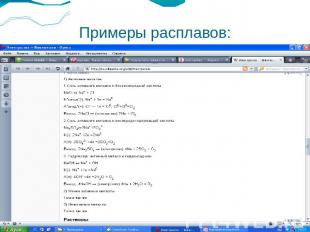
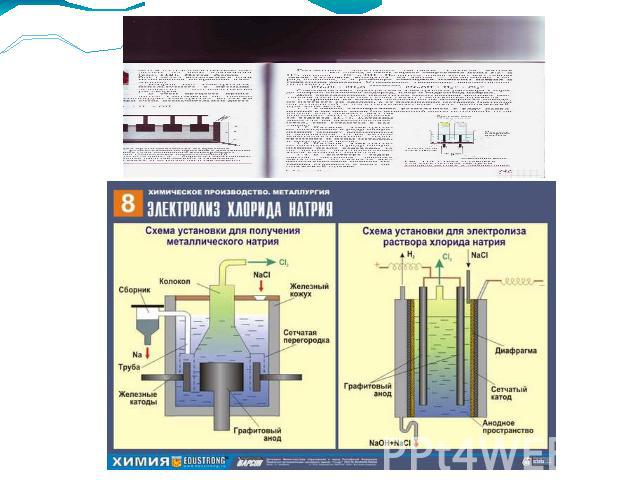
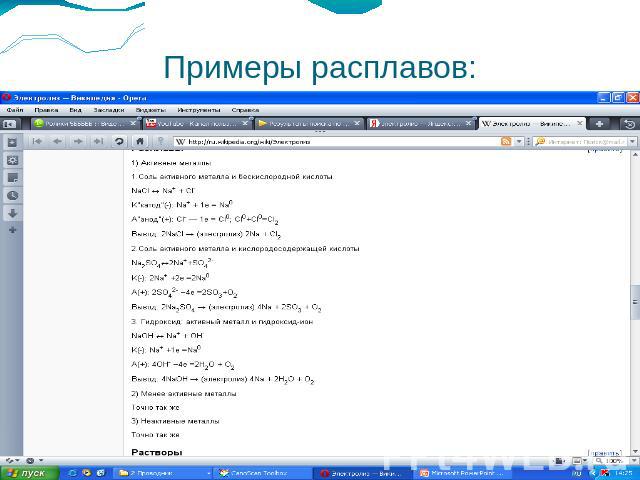
Примеры расплавов:
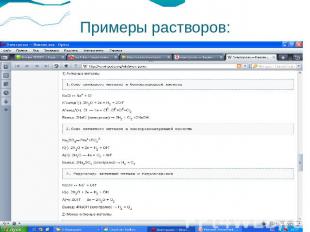
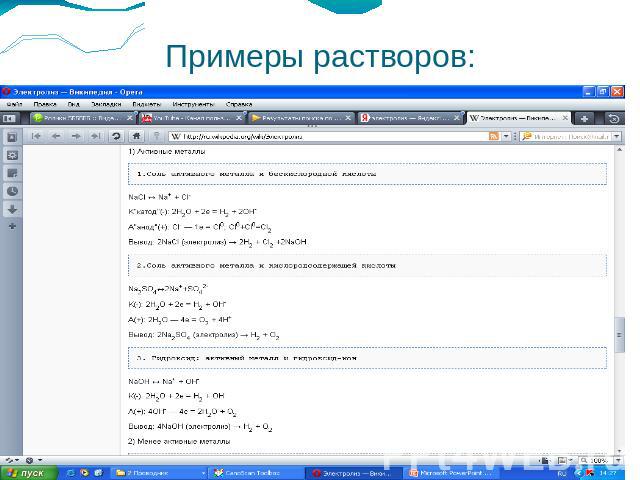
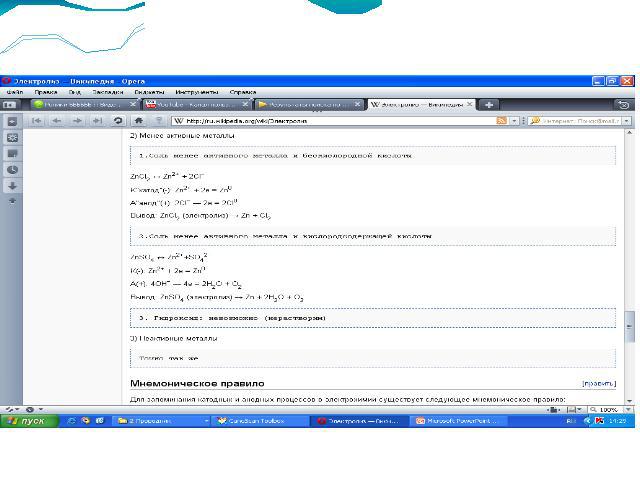
Примеры растворов:

В промышленности электролиз находит широкое применение: для получения щелочных, щелочноземельных металлов и алюминия; для получения галогенов, водорода и кислорода; для нанесения металлических покрытий на поверхность изделий — никелирование, хромирование, золочение (общее название таких процессов — гальваностегия); для изготовления рельефных металлических копий (гальванопластика); для очистки цветных металлов от примесей (рафинирование).