Презентация на тему: Окислительно-восстановительные реакции (ОВР) или «Кто-то теряет, кто-то находит»



Окислительно-восстановительные реакции (ОВР)или«Кто-то теряет, кто-то находит»Задачи урока:Познакомиться с понятиями: ОВР, окисление, восстановление, окислитель, восстановитель.Научиться по уравнениям реакций распознавать ОВР, определять окислитель, восстановитель

Входной контроль1 вариант1 - Г2 - А3 – Г4 – А5) А- 1 Б- 3 В- 3 Г- 4 2 вариант1 – В2 – В3 – Г4 – А5) А- 2 Б- 3 В- 1 Г- 4

Лабораторная работа А) Проведите химические реакцииВзаимодействия железа с сульфатом медиВзаимодействия растворов сульфата меди и раствором щелочи.Б) Запишите уравнения реакций в молекулярном и ионном виде. Укажите тип реакции В) Укажите различия данных реакций.

Fe0+Cu+2 SO4 = Fe SO4 + СuСуть ОВР – переход электронов от одних атомов, молекул или ионов к другим.

Какие два процесса происходят в ОВР? Fe0 + Cu+2SO4 = Cu0 + Fe+2SO4

ОкислительВосстановитель

Внимание!!!Самостоятельная работа...

Уэ-1 Значение ОВРОВР обеспечивают жизненно важные процессы организмов. Используются для получения различных веществ; для теплообеспечения

УЭ-2 Распознавание ОВР по химическим уравнениямОкислительно-восстановительную реакцию можно определить по изменению степени окисления у отдельных элементов, по наличию простого вещества и по типу химической реакции.1, 41вариант: Б,Г2 вариант: А,В

УЭ-3 Процессы окисления и восстановления.1. А) окисление (ок-ие),восстановитель (в-ль) Б) восстановление (в-ие), окислитель (ок-ль) В) окисление (ок-ие),восстановитель (в-ль) Г) восстановление (в-ие), окислитель (ок-ль)2. 1) увеличивается 3) уменьшается 2) уменьшается 4) увеличивается3. 1) Fe – 3е = Fe3+ - ок-ие, в-ль 2) C+4 + 2е =C+2 - в-ие, ок-ль 3) S+6 + 8е = S-2 - в-ие, ок-ль 4) P-3 – 3 =P0 - ок-ие, в-ль
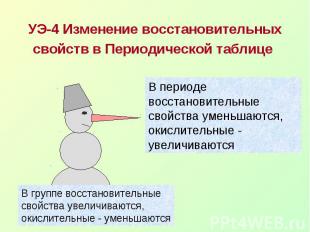
УЭ-4 Изменение восстановительных свойств в Периодической таблице В периоде восстановительные свойства уменьшаются, окислительные - увеличиваютсяВ группе восстановительные свойства увеличиваются, окислительные - уменьшаются

УЭ-4 Изменение восстановительных свойств в Периодической таблице2. а) Li, Na, K б) S, Si, Na3) а) С, O, F б) Br, Cl, F

Выходной контроль1 - Б2 - Б3 - В4 - А5 - Б

1 ВариантС0 + О20 = С+4О2-2C0 - 4e = C+4 - ок-ие, в-льO0 + 2e = O-2 - в-ие, ок-ль2Fe2+3O3+3C0 =4Fe0 +3C+4O2C0 - 4e = C+4- ок-ие, в-льFe+3 +3e = Fe0-в-ие, ок-ль2 ВариантC-4H4+ = C0 + 2H20C-4 – 4e = C0 - ок-ие, в-льH+ + 1e = H0 - в-ие, ок-льFe2+3O3 + 2Al0 = Al2+3O3 + 2Fe0Al0 -3e =Al+3- ок-ие, в-льFe+3 + 3e = Fe0 - в-ие, ок-ль

Домашнее заданиеСтр. 229-231, выучить определения.Стр.235. упр 1( «3») упр 1,3 («4») упр 1, 3, 5 ( «5»)

Закончите схемы процессов, укажите окислитель и восстановитель:При восстановлении степень окисления уменьшается, при окислении - возрастает

выводы:1)овр чрезвычайно распространены;2)суть овр-переход электронов от однихатомов,молекул или ионов к другим;3)овр-единство двух противоположных процессов-окисления и восстановления;

Окислительно-восстановительные реакции в природе и жизни человека:
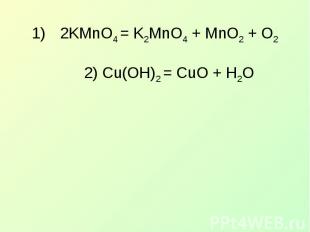
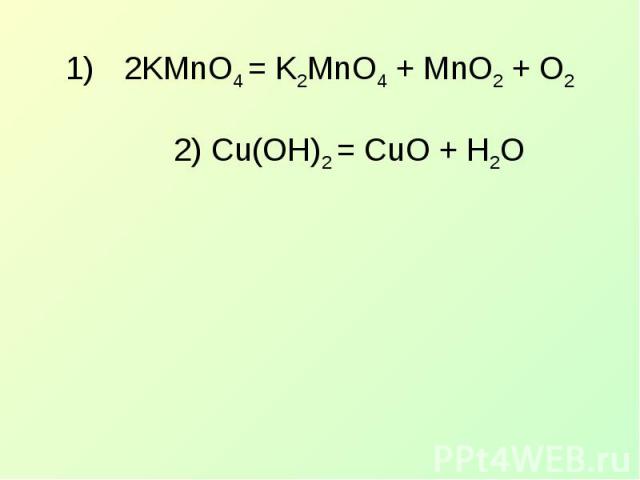
2KMnO4 = K2MnO4 + MnO2 + O22) Cu(OH)2 = CuO + H2O
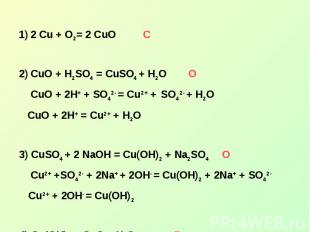
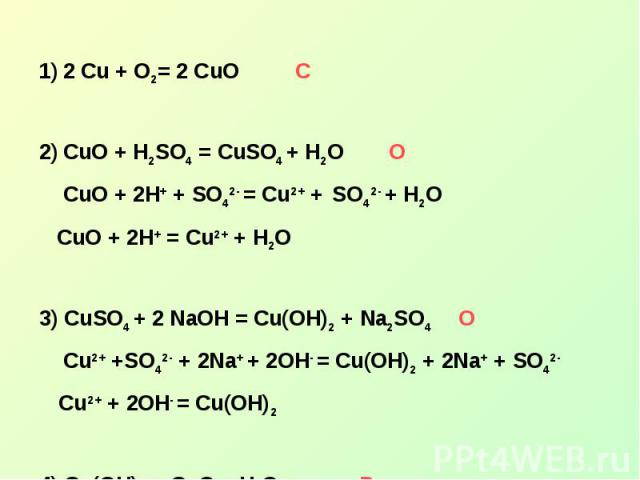
2 Cu + O2= 2 CuOСCuO + H2SO4 = CuSO4 + H2O О CuO + 2H+ + SO42- = Cu2+ + SO42- + H2O CuO + 2H+ = Cu2+ + H2O3) CuSO4 + 2 NaOH = Cu(OH)2 + Na2SO4 О Cu2+ +SO42- + 2Na+ + 2OH- = Cu(OH)2 + 2Na+ + SO42- Cu2+ + 2OH- = Cu(OH)24) Cu(OH)2 = CuO + H2O Р