Презентация на тему: Моль. Молярная масса

Моль. Молярная масса

ДОПОЛНИТЕ ПРЕДЛОЖЕНИЯ Известно неметаллаКристаллы йода цветаЖидкий неметалл Углерод образует и После грозы в воздухе есть

Укажите предложения, соответствующие металлам и неметаллам. Агрегатное состояние – твердое.Газообразные.Имеют металлический блеск.Пластичные.Газообразные.Не имеют металлического блеска.Электропроводны.Не проводят тепло.

Агрегатное состояние – твердое.Газообразные.Имеют металлический блеск.Пластичные.Газообразные.Не имеют металлического блеска.Электропроводны.Не проводят тепло.

КОЛИЧЕСТВО ВЕЩЕСТВА.
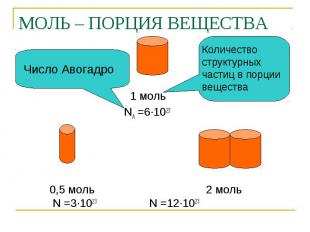
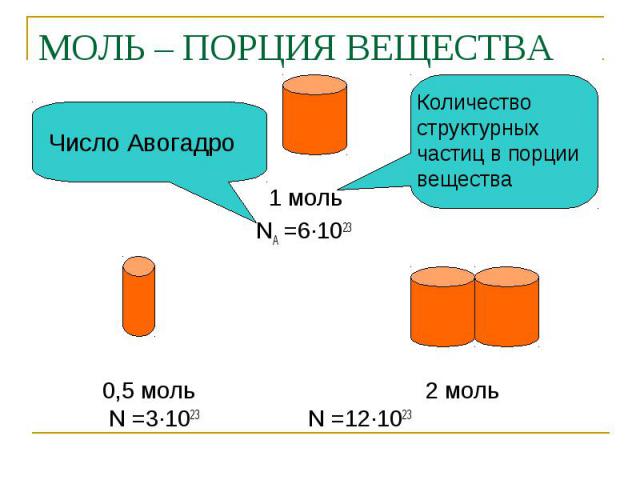
МОЛЬ – ПОРЦИЯ ВЕЩЕСТВА Число Авогадро Количество структурных частиц в порции вещества 1 моль NA =6∙1023 0,5 моль 2 моль N =3∙1023 N =12∙1023
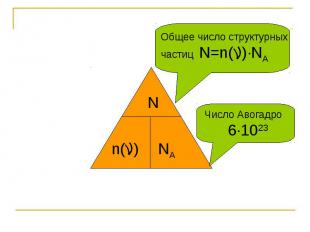
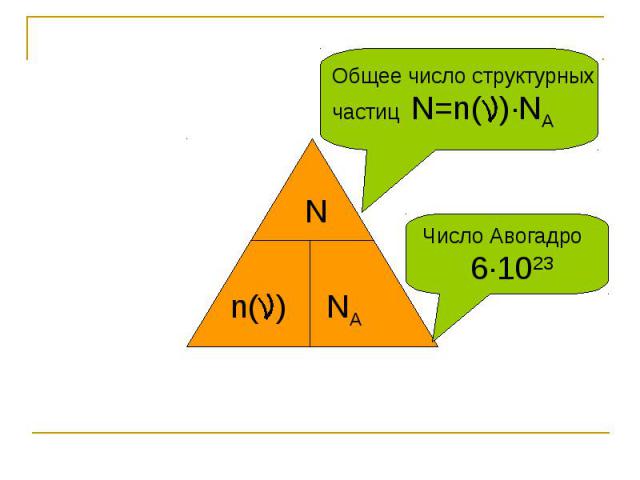
Общее число структурных частиц N=n( )∙NA Число Авогадро 6∙1023
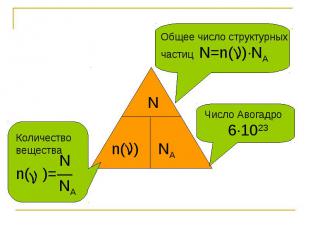
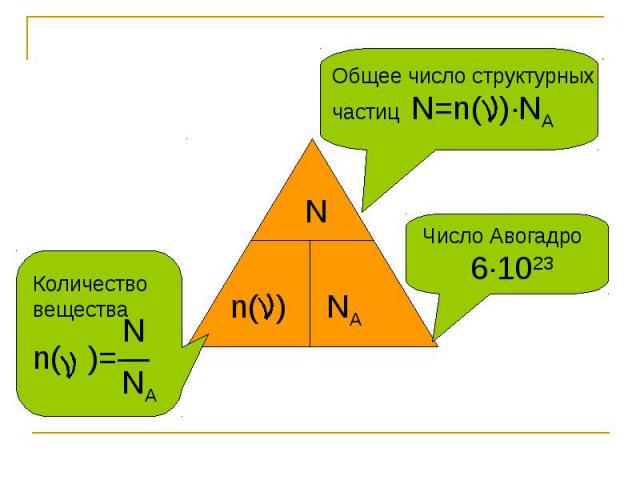
Общее число структурных частиц N=n( )∙NA Количество вещества Nn( )=― NA Число Авогадро 6∙1023

Сколько молекул кислорода (О2) содержится в 3 моль кислорода?В каком количестве вещества азот (N2) содержится 24∙1023 молекул азота?

Составьте задачу со словами: Фтор5 мольСколько молекул

Составьте задачу со словами: Фтор5 мольСколько молекул Сколько молекул фтора (F2) содержится в моль фтора?

Составьте задачу со словами: 36∙1023ОзонКоличество вещества

Составьте задачу со словами: 36∙1023ОзонКоличество вещества В каком количестве веществаозон (О3) содержится 36∙1023 молекул озона?
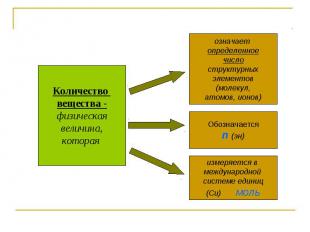
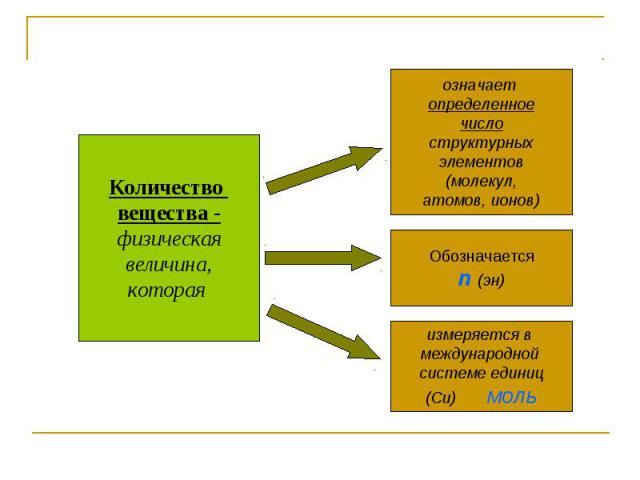
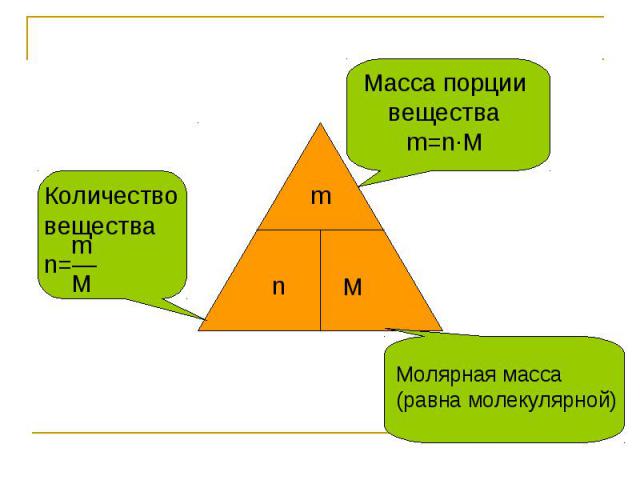
Количество вещества -физическаявеличина,которая означает определенноечислоструктурныхэлементов(молекул,атомов, ионов) Обозначаетсяn (эн) измеряется в международной системе единиц(Си) моль

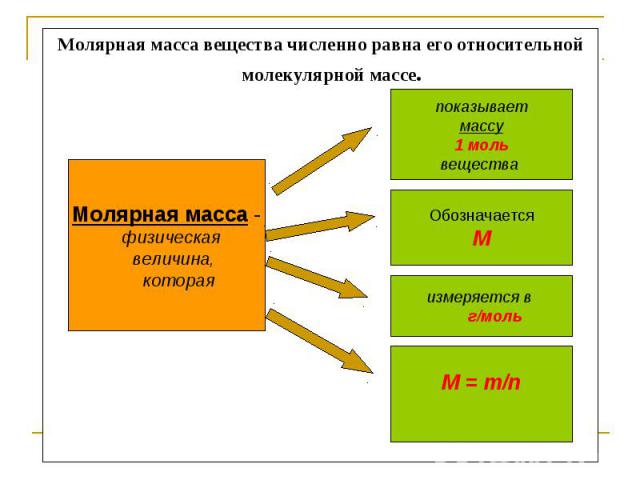
МОЛЯРНАЯ МАССА - это масса одного моль вещества ( молярная масса численно равна молекулярной массе)
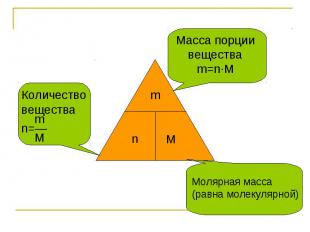
Количествовещества mn=― M Масса порции вещества m=n∙M Молярная масса(равна молекулярной)
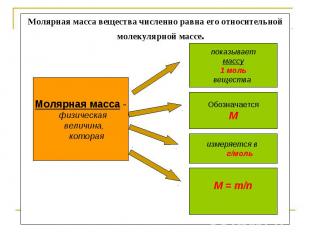
Молярная масса вещества численно равна его относительной молекулярной массе. Молярная масса - физическая величина, которая показываетмассу1 мольвещества ОбозначаетсяМ измеряется в г/моль М = т/n