Презентация на тему: Окислительно - восстановительные свойства серной кислоты

Окислительно - восстановительные свойства серной кислоты

Едва ли найдётся другое, искусственно добываемое, вещество, столь часто применяемое в технике, как серная кислота. Там, где техническая деятельность развита, там потребляется и много серной кислоты. Д. И. Менделеев

Реакции разбавленной серной кислоты с активными металлами 2Li + H2 SO4 = Li2SO4 + H2 ↑ Li 0 - 1 e → Li+ *2 восстановитель 2H + + 2e → H2 0 окислительCa + H2 SO4 = CaSO4 + H2 ↑ Ca 0 - 2 e → Ca 2 восстановитель 2H + + 2e → H2 0 окислитель

Реакции разбавленной серной кислоты с металлами средней активности Zn + H2SO4 = ZnSO4 + H2 ↑ Zn0 - 2e → Zn 2+ восстановитель 2H+ + 2e → H2 окислитель

Реакции разбавленной серной кислоты с алюминием и железом 2Al + 3H2 SO4 = Al2(SO4)3+3H2 ↑Al0 – 3e →Al+3 *2 восстановитель 2H+ + 2e → H2 *3 окислительFe+ H2SO4 = FeSO4 + H2↑ Fe0 -2e →Fe+2 *1 восстановитель 2H+ + 2e → H2 *1 окислитель

Реакции разбавленной серной кислоты с малоактивными металлами Cu + H2SO4 - не взаимодействует

Реакции концентрированной серной кислоты с активными металлами 8Na + 5H2 SO4 (k) = H2S + 4Na2SO4 + 4H2O Na 0 - 1 e → Na+ *8 восстановитель S+6 +8e →S-2 *1 окислитель

Реакции концентрированной серной кислоты с металлами средней активности Zn + 2H2 SO4 = ZnSO4 + 2H2O + SO2Zn 0 - 2 e → Zn+ 2 восстановительS+6 + 2 e → S+4 окислитель4Zn + 5H2 SO4 = 4ZnSO4 + 4H2O + H2SZn 0 - 2 e → Zn+ 2 *4 восстановитель S+6 + 8 e → S-2 *1 окислитель3Zn + 4H2 SO4 = 3ZnSO4 + 4 H2O + SZn 0 - 2 e → Zn+ 2 *3 восстановитель S+6 + 6 e → S0 *1 окислитель

На холоде концентрированная серная кислота пассивирует многие металлы, в том числе РЬ, Cr, Ni, сталь, чугун.При нагревании реакционной смеси происходит химическая реакция:8Al+15 H2SO4 =4 Al2(SO4)3+3H2S↑ +12H2OAl0 – 3e →Al+3 *8 восстановитель S+6 +8e →S-2 *3 окислитель 8Fe+15 H2 SO4 =4 Fe2(SO4)3+3H2 S↑ +12H2OFe0 – 3e →Fe+3 *8 восстановитель S+6 +8e →S-2 *3 окислитель

Реакции концентрированной серной кислоты с малоактивными металлами Cu + 2H2 SO4 = CuSO4 + 2H2O + SO2Cu 0 - 2 e → Cu+ 2 восстановительS+6 + 2 e → S+4 окислитель

Реакции концентрированной серной кислоты с неметаллами S + 2H2 SO4 = 2H2O + 3SO2S 0 - 4 e → S+4 восстановительS +6 + 2 e → S+4 *2 окислитель2P + 5H2 SO4 = 2H3PO4 + 5SO2 + 2H2OP 0 - 5 e → P 5+ *2 восстановитель S 6+ +2e → S+4 *5 окислитель

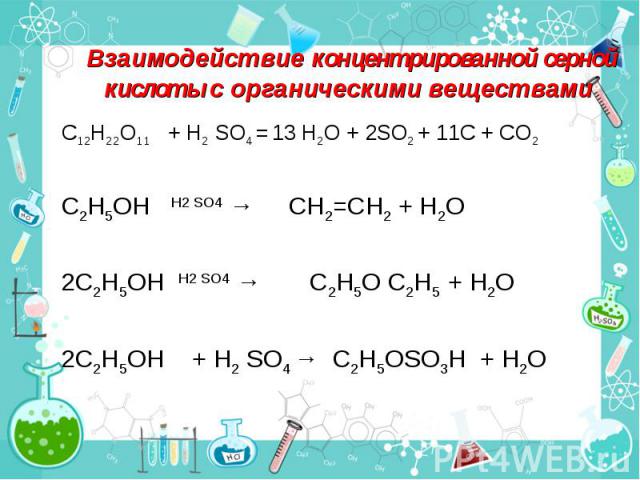
Взаимодействие концентрированной серной кислоты с органическими веществами С12Н22О11 + H2 SO4 = 13 H2O + 2SO2 + 11С + СО2 C2H5OH H2 SO4 → CH2=CH2 + H2O 2C2H5OH H2 SO4 → C2H5O C2H5 + H2O 2C2H5OH + H2 SO4 → C2H5OSO3H + H2O

Концентрированная серая кислoта обугливает органические вещества. Правила техники безопасности:Работать с кислотами необходимо аккуратно, так как можно получить ожог или отравление. При попадании кислоты на кожу надо смыть ее струей воды.