Презентация на тему: Основные соединения серы

Основные соединения серы

Обучающие: изучить строение основных соединений серы; изучить распространение соединений серы в природе, применение основных соединений серы и их воздействие на окружающую среду.Развивающие: развить представление учащихся о важнейших соединениях серы.Воспитательные: продемонстрировать практическую направленность знаний о соединениях серы.

Основные соединения серы: Н2S – сероводород; SO2 - серный газ;SO3 -сернистый ангидрид;Н2SO3 - сернистая кислота; Н2SO4 - серная кислота
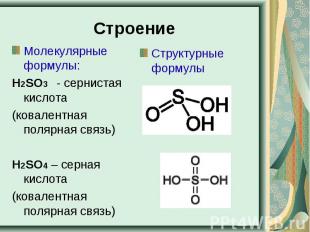
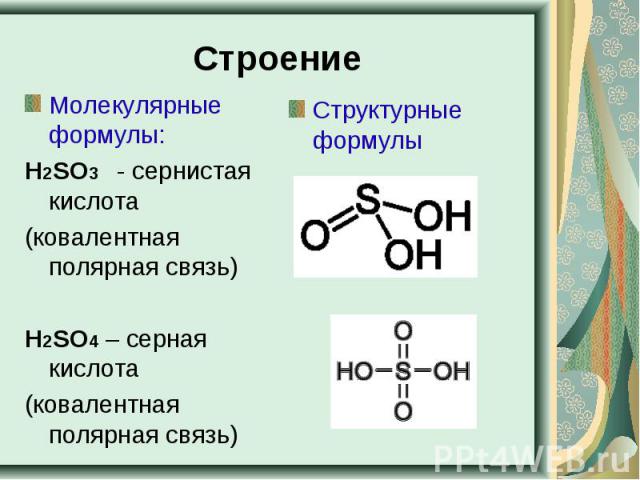
Строение Молекулярные формулы:Н2SO3 - сернистая кислота (ковалентная полярная связь)Н2SO4 – серная кислота(ковалентная полярная связь)
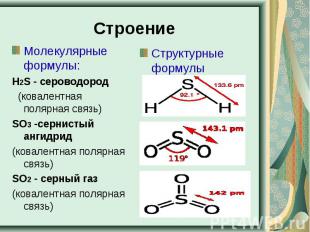
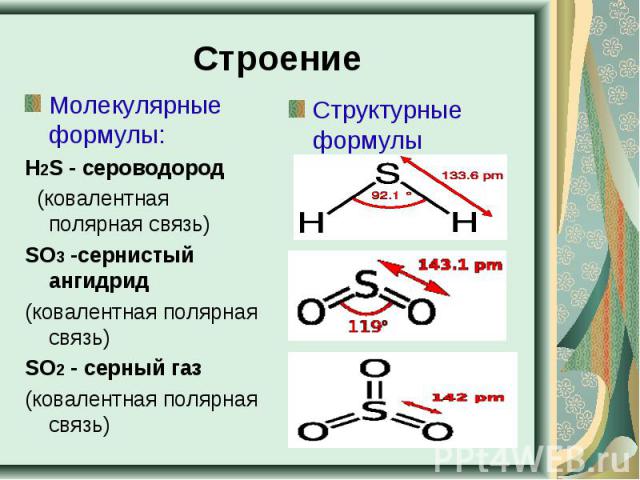
Строение Молекулярные формулы:Н2S - сероводород (ковалентная полярная связь)SO3 -сернистый ангидрид(ковалентная полярная связь)SO2 - серный газ (ковалентная полярная связь) Структурные формулы

ГидросульфидыNaHS- гидросульфид натрияBa(HS)2- гидросульфид бария СульфидыNa2S – сульфид натрияZnS – сульфид цинкаPbS- сульфид свинца

Серная кислоты – H2SO4 Плотность серной кислоты – 1,84 г /см3, Концентрированная серная кислота – это бесцветная маслянистая жидкость, без запаха, примерно в два раза тяжелее воды.


СЕРОВОДОРОД Бесцветный газ с резким запахом тухлых яицТермически неустойчив, плохо растворим в воде. Лучше, чем в воде, сероводород растворим в органических растворителях; температура кипения - 60,35 °С, плотность 0,938 г/см3 (-81 °С)Водный раствор – сероводородная кислота (слабая)

SO2 – сернистый газ. Очень токсичен.В нормальных условиях представляет собой бесцветный газ с характерным резким запахом. Под давлением сжижается при комнатной температуре. Растворяется в воде - растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле, серной кислоте. SO2 — один из основных компонентов вулканических газов.

H2S является очень слабой кислотой:H2S → HS− + H+Сероводород — сильный восстановитель. На воздухе горит синим пламенем:2H2S + ЗО2 = 2Н2О + 2SO2при недостатке кислорода:2H2S + O2 = 2S + 2H2O (на этой реакции основан промышленный способ получения серы).

SO3 — типичный кислотный оксид, ангидрид серной кислоты 1. Кислотно-основные: При взаимодействии с водой образует серную кислоту:SO3 + H2O → H2SO4Взаимодействует с основаниями:2KOH + SO3 → K2SO4 + H2O,основными оксидами:CaO + SO3 → CaSO4,c амфотерными оксидами:3SO3 + Al2O3 → Al2(SO4)3


Нахождение соединений серы в природе Самородная сера Сульфидная сера Сульфатная сера
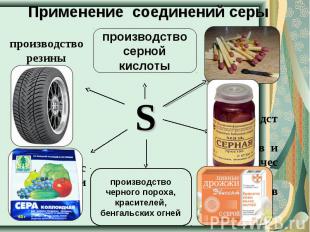
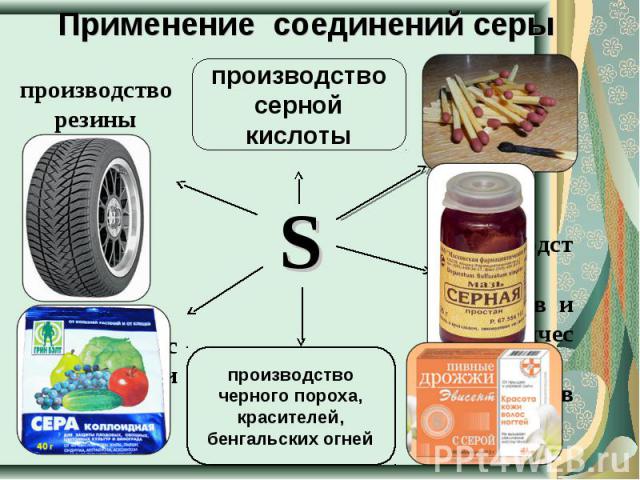
Применение соединений серы производство резины производство серной кислоты производство черного пороха, красителей, бенгальских огней

Используемые ресурсы Аликберова Л.Ю. Занимательная химия. М.: Изд-во "АСТ - ПРЕСС", 1999Гроссе Э.. Химия для любознательных. Ленинград, 1995 CD/ издательство «Учитель» компакт-диск -2009 г.Новый справочник по химии. М., «Большая медведица», 1999г.Мультимедийное приложение к УМК «Химия» 9 класс. Электронное учебное издание. Дрофа.Энциклопедический словарь юного химика., М., Педагогика, 2005 гhttp://schoolchemistry.by.ru/katalog/sernayakislota.htm http://schoolchemistry.by.ru/katalog/sernayakislota.htm