Презентация на тему: Основания. Химические свойства. Способы получения

Основания. Химические свойства. Способы получения

Гидроксид – ионы (ОН-), образующиеся при диссоциации оснований, обуславливают их химические свойства 1. Действие на индикаторы

Химические свойства оснований(щелочей и нерастворимых оснований) 2. Взаимодействие с кислотами Cu(OH)2 + H2SO4=CuSO4 + 2H 2Oнерастворимое + кислота = соль + вода основаниеCu(OH)2 + 2H+ + SO42- = Cu2+ + SO4 2- + 2H2OCu(OH)2 + 2H += Cu2+ + 2H2O Реакция нейтрализации – реакция между кислотой и основанием
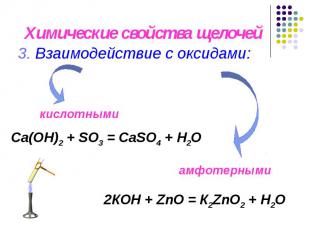
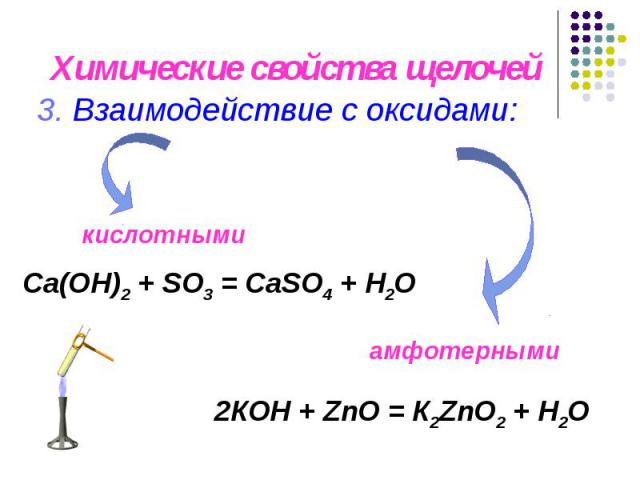
Химические свойства щелочей 3. Взаимодействие с оксидами: Са(OН)2 + SO3 = СаSO4 + H2O 2КOН + ZnO = К2ZnO2 + H2O

4. Взаимодействие с растворами солей: Химические свойства щелочей 2NaОН + CuSO4 → Cu(OH)2 + Na2SO4
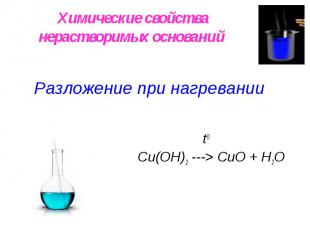
Химические свойства нерастворимых оснований Разложение при нагревании t0 Сu(OН)2 ---> СuO + H2O

Способы получения растворимых оснований (щелочей) 1. Взаимодействие щелочных и щелочно-земельных металлов с водой 2Na + 2H2O = 2NaOH + H22. Взаимодействие оксидов щелочных и щелочно-земельных металлов с водой СаO + H2O = Са(OН)2

Способы получения нерастворимых оснований Взаимодействие раствора щелочи с раствором соли АlCl3 + 3NaOH = Al(OH)3 + 3NaCl 2NaОН + CuSO4 → Cu(OH)2 + Na2SO4