Презентация на тему: Классы неорганических соединений

Классы неорганических соединений Подготовка к ЕГЭ

Оксиды Образованы двумя химическими элементами Один из элементов кислород, имеющий степень окисления -2Примеры: MgO, H2O

Оксидами являются оба вещества в паре1)MgO и H2O2 2)Na 2O2 и BaO 3)Mn2О7 и N2O34)F2О и P2O5

Классификация оксидовНесолеобразующие (безразличные)ОсновныеКислотныеАмфотерные

Основные оксидыОксиды металлов, в которых металл имеет степень окисления +1 или +2 как правилоОсновным оксидам соответствуют основания (основные гидроксиды): Na2O – NaOH MgO – Mg(OH)2

Свойства основных оксидов Реагируют с кислотами: MgO + H2SO4 = MgSO4 + H2OНекоторые реагируют с водой (оксиды щелочных и щелочно-земельных металлов):Na2O + H2O = 2NaOHРеагируют с кислотными оксидами: CaO + CO2 = CaCO3

Кислотные оксиды Оксиды неметаллов и металлов, в которых элемент имеет степень окисления +4 и выше как правило Кислотным оксидам соответствуют кислоты (кислотные гидроксиды):CO2 – H2CO3Mn2O7 – HMnO4SO3 – H2SO4CrO3 – H2CrO4, H2Cr2O7

Свойства кислотных оксидов Реагируют со щелочами (растворимыми в воде основаниями):CO2 + 2NaOH = Na2CO3 + H2OБольшинство реагирует с водой:SO3 + H2O = H2SO4 Реагируют с основными оксидами: P2O5 + 3CaO = Ca3(PO4)2

Амфотерные оксиды Оксиды металлов, в которых металл проявляет степень окисления +3 или +4 как правило Амфотерным оксидам соответствуют амфотерные гидроксиды:Al2O3 – Al(OH)3ZnO – Zn(OH)2Cr2O3 – Cr(OH)3 BeO – Be(OH)2MnO2 – Mn(OH)4

Свойства амфотерных оксидов Амфотерность – двойственность свойствРеагируют с кислотами, проявляя свойства основных оксидов:Al2O3 + 6HCl = 2AlCl3 + 3H2OРеагируют со щелочами, проявляя свойства кислотных оксидов: Al2O3 + 2NaOH + 3H2O= 2Na[Al(OH)4]Al2O3 + 2NaOH = 2NaAlO2 + H2O (при сплавлении)

С водой реагируют оксиды: 1)BaO и SiO22)СuO и SO33)BaO и SO34)FeO и СО2

Оксид серы (IV) взаимодействует с каждым из двух веществ:1)H2O и KCl2)Ba(OH)2 и CaO 3)CaCO3 и ZnSO34)Ca(OH)2 и N2

С соляной кислотой реагируют каждый из двух оксидов1)K2O и SO32)Al2O3 и CaO 3)CO2 и ZnO4)CrO3 и Na2O

И с раствором гидроксида натрия и с серной кислотой реагирует 1)ВаO 2) Cr2O3 3) SiO2 4) MgO

ГидроксидыОсновные – основания (щелочи и нерастворимые в воде)Кислотные – кислоты кислородсодержащиеАмфотерные

Только кислоты расположены в ряду1)HNO3, Ca(NO3)2, NO22)KHCO3, Ba(HSO4)2, Zn(OH)Cl3)HNO2, HNO3, CH3COONa4)H2S, Н2SO3, CH3COOH

Оцените правильность следующих суждений:А) Гидроксиды по свойствам делятся на кислоты, основания и амфотерные гидроксиды. Б) Гидроксиды элементов главных подгрупп первой и второй групп Периодической системы – растворимые основания (щелочи).1)верно только А2)верно только Б3)верны оба суждения4)оба суждения неверны

Щелочи – растворимые в воде основанияЩелочи образуют металлы 1 группы главной подгруппы (щелочные металлы) и щелочноземельные металлы (Ca, Sr, Ba)Примеры: NaOH, Ca(OH)2

Свойства щелочейРеагируют с кислотами: 2NaOH + H2SO4 = Na2SO4 + 2H2OРеагируют с кислотными оксидами:2NaOH + CO2 = Na2CO3 + H2OРеагируют с растворами солей, если выпадает осадок:2NaOH+ CuSO4 = Cu(OH)2↓ + Na2SO4Реагируют с металлами, образующими амфотерные оксиды и гидроксиды:2NaOH + Zn +2H2O = Na2[Zn(OH)4] + Н2

Нерастворимые в воде основания Реагируют с кислотами:Mg(OH)2 + 2HNO3 = Mg(NO3)2 +2H2OРазлагаются при нагревании:Mg(OH)2 = MgO +H2O

Кислотные гидроксиды – кислородсодержащие кислотыРеагируют с основаниями:KOH + HNO3 = KNO3 + H2OРеагируют с основными оксидами:MgO + H2SO4 = MgSO4 + H2OРеагируют с металлами, стоящими в ряду напряжений до водорода:Mg + H2SO4 = MgSO4 + H2Реагируют с солями:Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2

Амфотерные гидроксидыРеагируют с кислотами, проявляя свойства оснований:Al(OH)3 + 3HCl = AlCl3 + 3H2OРеагируют со щелочами, проявляя свойства кислот:Al(OH)3 + NaOH = Na[Al(OH)4]

Гидроксид натрия не взаимодействует с 1)CuCl22)SO23)PbS4)HNO3

Гидроксид натрия реагирует со всеми веществами ряда:1)Zn, Na 2CO3, CuO2)CO2, H3 PO4 CuO3)S O3, H3PO 4, AI2O34)SO3, MgO, H3PO4,

Гидроксид калия реагирует со всеми веществами группы1)Zn, SiO2, H2O2)HNO3, Na2CO3, Mg3)CuSO4, SO3, H3PO44)CuO, Cа(OH)2, N2O5

В ряду превращений: CuO→CuCl2→Cu(OH)2 вещества X и Y соответственно 1)НСl и NaOH2)HCl и Fe(OH)33)NaCl и Н2O4)Cl2 и H2O

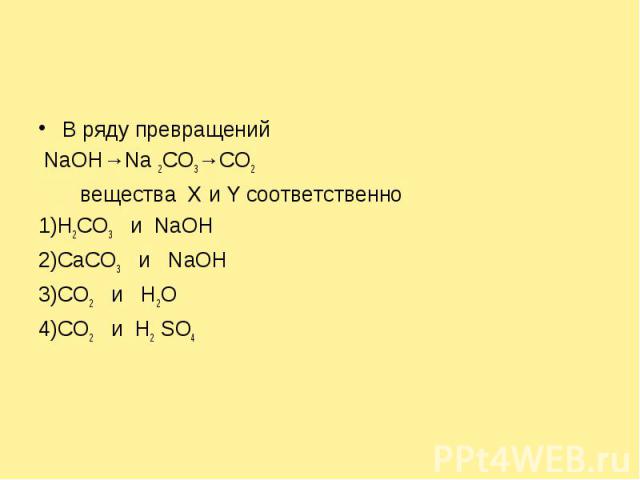
В ряду превращений NaOH→Na 2CO3→CO2 веществa X и Y соответственно 1)Н2CO3 и NaOH2)CaCO3 и NaOH3)CO2 и H2O4)CO2 и H2 SO4

Каждое из перечисленных веществ: CuCl2, SO3, H3PO4, Zn(OH)2реагирует с 1)серной кислотой 2)водой 3)гидроксидом натрия 4)оксидом углерода(VI)

При действии избытка раствора гидроксида натрия на раствор сульфата цинка образуется 1) ZnO 2) Zn(OH)2 3) Na2ZnO2 4)Na2[Zn(OH)4]

Исходные веществаА) Al + NaOH + H2OБ) Al2O3+ NaOH ( плавление)В) Al2O3+ NaOH+ H2OГ) Al(OH)3+ NaOH










![Свойства амфотерных оксидов Амфотерность – двойственность свойствРеагируют с кислотами, проявляя свойства основных оксидов:Al2O3 + 6HCl = 2AlCl3 + 3H2OРеагируют со щелочами, проявляя свойства кислотных оксидов: Al2O3 + 2NaOH + 3H2O= 2Na[Al(OH)4]Al2O… Свойства амфотерных оксидов Амфотерность – двойственность свойствРеагируют с кислотами, проявляя свойства основных оксидов:Al2O3 + 6HCl = 2AlCl3 + 3H2OРеагируют со щелочами, проявляя свойства кислотных оксидов: Al2O3 + 2NaOH + 3H2O= 2Na[Al(OH)4]Al2O…](https://fs1.ppt4web.ru/images/5345/79043/640/img9.jpg)











![Амфотерные гидроксидыРеагируют с кислотами, проявляя свойства оснований:Al(OH)3 + 3HCl = AlCl3 + 3H2OРеагируют со щелочами, проявляя свойства кислот:Al(OH)3 + NaOH = Na[Al(OH)4] Амфотерные гидроксидыРеагируют с кислотами, проявляя свойства оснований:Al(OH)3 + 3HCl = AlCl3 + 3H2OРеагируют со щелочами, проявляя свойства кислот:Al(OH)3 + NaOH = Na[Al(OH)4]](https://fs1.ppt4web.ru/images/5345/79043/640/img21.jpg)





![При действии избытка раствора гидроксида натрия на раствор сульфата цинка образуется 1) ZnO 2) Zn(OH)2 3) Na2ZnO2 4)Na2[Zn(OH)4] При действии избытка раствора гидроксида натрия на раствор сульфата цинка образуется 1) ZnO 2) Zn(OH)2 3) Na2ZnO2 4)Na2[Zn(OH)4]](https://fs1.ppt4web.ru/images/5345/79043/640/img28.jpg)