Презентация на тему: Исследование морей кислот

Разминка

Исследование морей кислот Загадочны морей просторы…Что там – под толщей темных вод?Долины, впадины, и горы Веществ сплошной круговорот…К. Паустовский

Маршрут нашего путешествия

Залив Информационный ПланЗнакомство с морем кислот;Разнообразие кислот;Получение кислот.

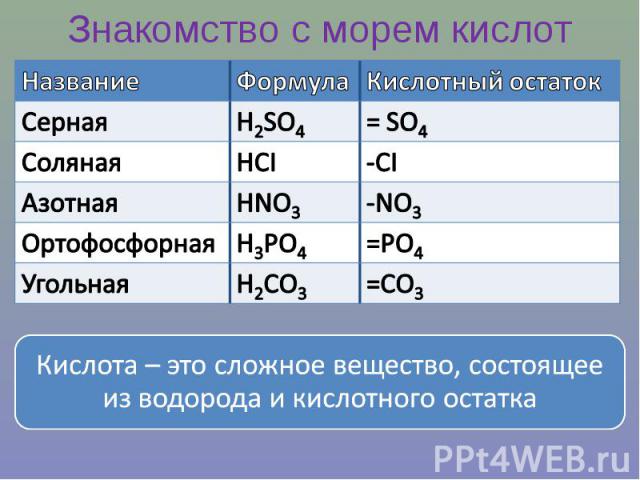
Знакомство с морем кислотКислота – это сложное вещество, состоящее из водорода и кислотного остатка

Разнообразие кислот Немало кислот содержится в нашей пище и лекарствах. Фрукты, овощи, молочные продукты, соусы, приправы ежедневно поставляют нам целый «букет» кислот: яблочную, винную, кофейную, уксусную, аскорбиновую, камфорную, валериановую и др

Природные кислотыМуравьиная кислотаЩавелевая кислота

Получение кислотПри взаимодействии кислотных оксидов с водой образуются кислоты

Стоп! Опасно! Бермудский треугольникПланТехника безопасности при обращении с кислотами;Оказание первой помощи;3. Физические свойства кислот;

Техника безопасности

Запомни!Сначала вода, затем кислотаИначе может случиться беда!

Оказание первой помощи при ожогах кислотой
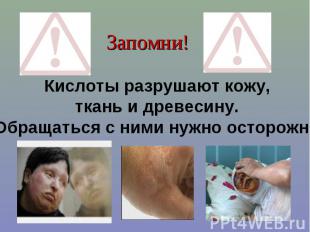
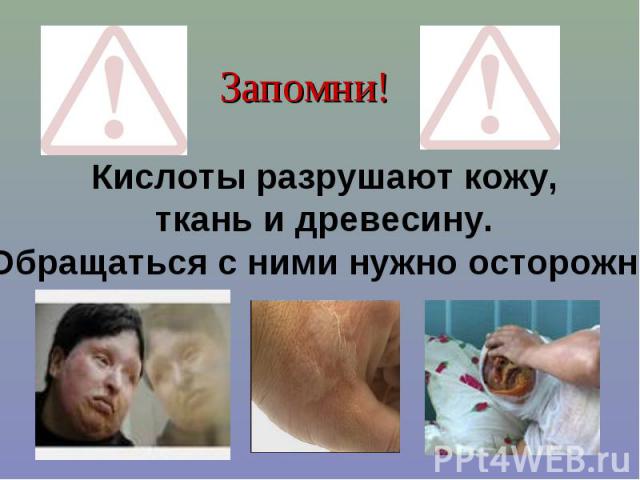
Запомни!Кислоты разрушают кожу, ткань и древесину. Обращаться с ними нужно осторожно!

Физические свойства кислотКонцентрированная серная кислота обугливает сахар и ткань

Отдохнем?Море, море – мир бездомный,Пенный шелест волн прибрежных.Над тобой встают как зори,Над тобой встают как зориНашей юности надежды!Смотрим, слушаем и повторяем!

Гавань Индикаторно - экспериментальнаяХимические свойства кислот;Открытие индикаторов;Исследование химических свойств кислот индикаторами.

Химические свойства кислотКислоты реагируют:С металлами (образуется соль и водород).С основными оксидами (образуется соль и вода).С основаниями (образуется соль и вода).С солями (образуется новая соль и новая кислота).С индикаторами (меняется окраска индикаторов)

Открытие индикаторовПостепенно химики научились распознавать кислоты. Однажды английский химик Р. Бойль, изучая свойства соляной кислоты, случайно пролил её на лепестки синей фиалки – лепестки стали красными. Так были открыты индикаторы.

Запомни!Индикаторы краснеют в кислотах, т.е. в кислой среде!

Запомни!Кислоты, полученные в лаборатории и кислоты в продуктах питания проявляют общие химические свойства!

Бухта ПримененияПланУгольная кислота;Серная кислота;Ортофосфорная кислота;Азотная кислота;Соляная кислота.

Угольная кислота Н2CО3

Серная кислота Н2SО4Серную кислоту применяют:в производстве минеральных удобрений;как электролит в свинцовых аккумуляторах;для получения различных минеральных кислот и солей;в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ;в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности.

Ортофосфорная кислота Н3РООртофосфорную кислоту применяют:при пайке в качестве флюса (по окисленой меди, по чёрному металлу, по нержавеющей стали);для исследований в области молекулярной биологии;для очищения от ржавчины металлических поверхностей;в пищевой промышленности;в сельском хозяйстве. В звероводстве (в частности, при выращивании норок); в стоматологии.

Азотная кислота НNО3Азотная кислота применяется:в производстве минеральных удобрений;в военной промышленности;в фотографии — подкисление некоторых тонирующих растворов;в станковой графике — для травления печатных форм.
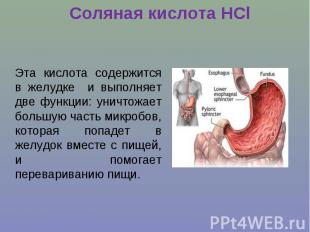
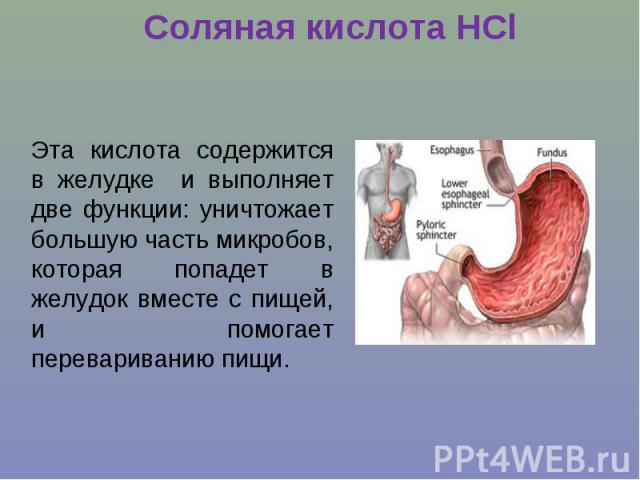
Соляная кислота НClЭта кислота содержится в желудке и выполняет две функции: уничтожает большую часть микробов, которая попадет в желудок вместе с пищей, и помогает перевариванию пищи.

Пролив ЗакрепленияПланХимические реакции;Найди соответствие.

Химические реакцииАI + HCI = AICI2+ H2↑Mg + H2CO3 = MgCO3 + H2↑Zn + H2SO4 = ZnSO4 + H2↑

Спасибо за внимание!