Презентация на тему: Основные классы неорганических соединений

Основные классы неорганических соединений

Содержание: Классификация неорганических веществ; Классификация оксидов; Получение оксидов; Получение пероксида водорода; Химические свойства пероксида водорода.
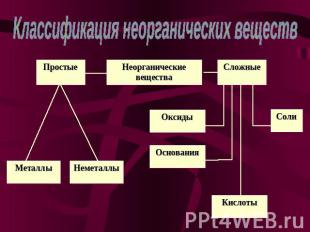
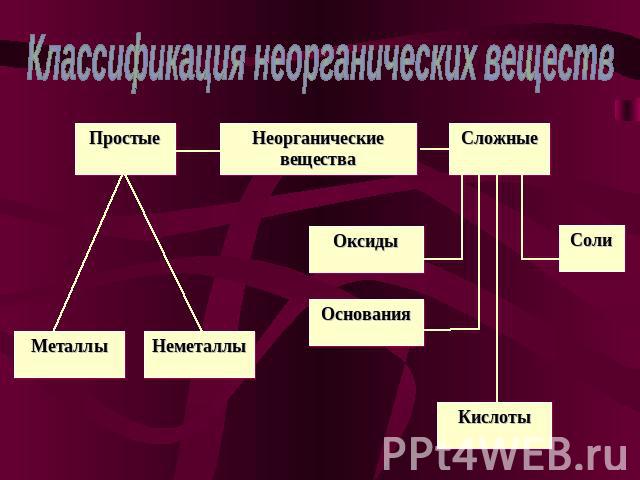
Классификация неорганических веществ
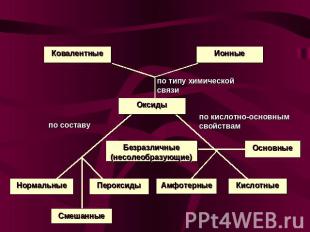
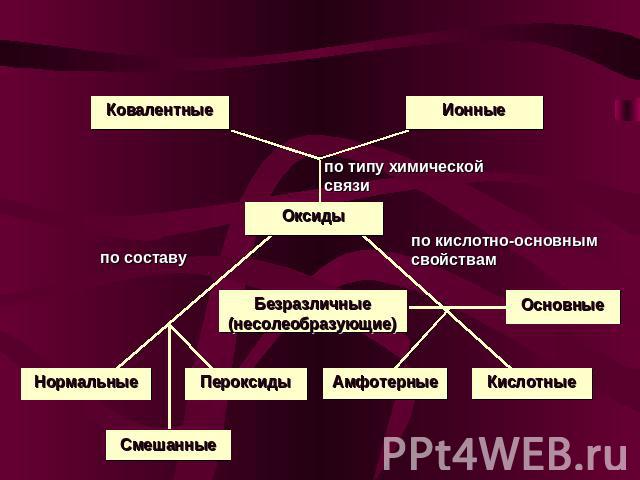
Классификация оксидов

Классификация оксидов Нормальные оксиды – оксиды, в которых есть только связи между кислородом и каким-нибудь элементом. Примеры: MgO, SO3 , SiO2; Пероксиды – оксиды, в которых есть связи между двумя атомами кислорода. Примеры: Na2O2, H2O2; Смешанные оксиды – оксиды, которые представляют собой смесь двух одного элемента в разных степенях окисления. Примеры:Pb3O4 = 2PbO + PbO2;Fe3O4 = FeO + Fe2O3 Кислотные оксиды (ангидриды) – оксиды, которые реагируют с водой, образуя кислоты; с основаниями и основными оксидами образуют соли. Примеры: SO3, SO2, Mn2O7;

Классификация оксидов Основные оксиды – оксиды, которые реагируют с водой, образуя основания; с кислотами и кислотными оксидами образуют соли. Примеры: CaO, Na2O; Амфотерные оксиды – оксиды, которые в зависимости от условий проявляют свойства и кислотных, и основных оксидов. Примеры: ZnO, Al2O3; Безразличные (несолеобразующие) оксиды – оксиды, которые не реагируют ни с кислотами, ни с основаниями. Солей не образуют. Примеры: NO, N2O.

Оксид хрома и периклаз

Циркон

Получение оксидов Взаимодействие простых веществ с кислородом. Примеры: S + O2—› SO2; 4Al + 3O2 —› 2Al2O3; Термическое разложение оснований, солей, кислот. Примеры: CaCO3—t› CaO + CO2 ; 2H3BO3 —t› B2O3 + H2O ; Mg(OH)2 —t› MgO + H2O; Взаимодействие простых веществ и солей с кислотами-окислителями. Примеры: C + 4HNO3(р-р) —› СO2 + 4NO2 + H2O; Cu + 4HNO3(конц.) —› Cu(NO3)2 + 2NO2 + + 2H2O; Na2SO3 + 2H2SO4—› 2NaHSO4 + SO2 + H2O.

Получение оксидов металлов (установка)

Получение пероксида водорода Взаимодействие пероксида бария с разбавленной серной кислотой. Примеры: BaO2 +H2SO4 —› BaSO4 + H2O2; Взаимодействие надсерной кислоты с водой. Примеры:H2SO8 + 2H2O—› 2H2SO4 + H2O2; Взаимодействие азота с водой. Примеры: O3 + H2O—› H2O2 + O2; Реакция, протекающая при действии электрического разряда на воду. Примеры: H2O —разряд› H2O2 +1/2H2.

Получение пероксида водорода
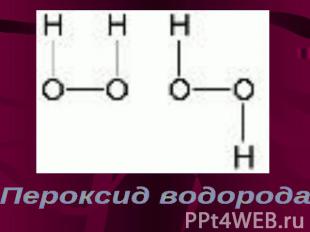
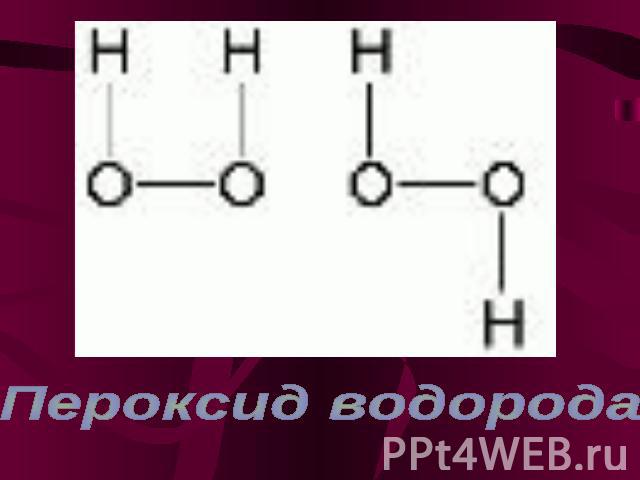
Пероксид водорода

Химические свойства пероксида водорода Разложение. Пример: H2O —› H2O + 1/2O2; Окисление. Пример: PbS + 4H2O2 —› PbSO4 + 4H2O; Восстановление. Пример: 2KMnO4 + 5H2O2 + 3H2SO4 —› —› K2SO4 + 2MnSO4 + 5O2 + 8H2O.

Конец