Презентация на тему: Окислительно – восстановительные реакции


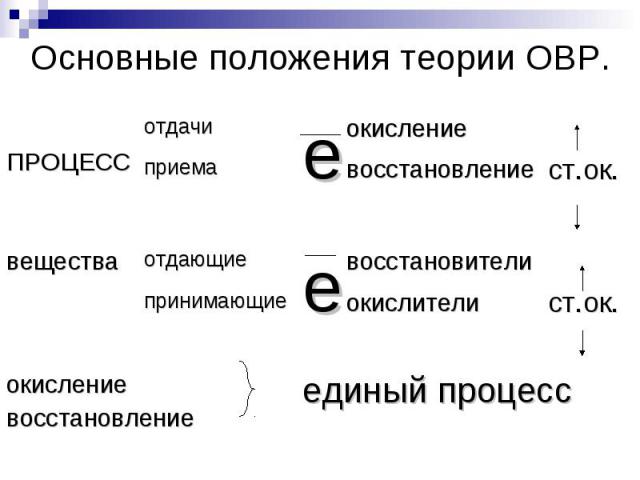
Окислительно – восстановительные реакции… – реакции, протекающие с изменением степени окисления элементов.

Два антипода парою ходят,Первый – теряет; второй - находит,Ролью меняясь при этом порой…Кто ж из них первый и кто же второй?восстановительокислитель
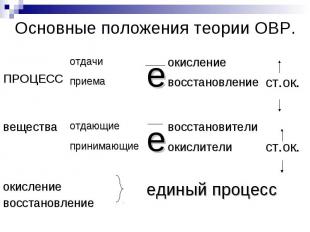
Основные положения теории ОВР.
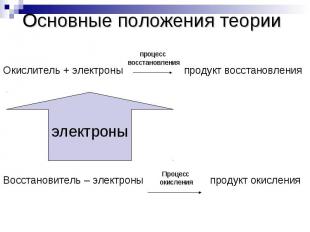
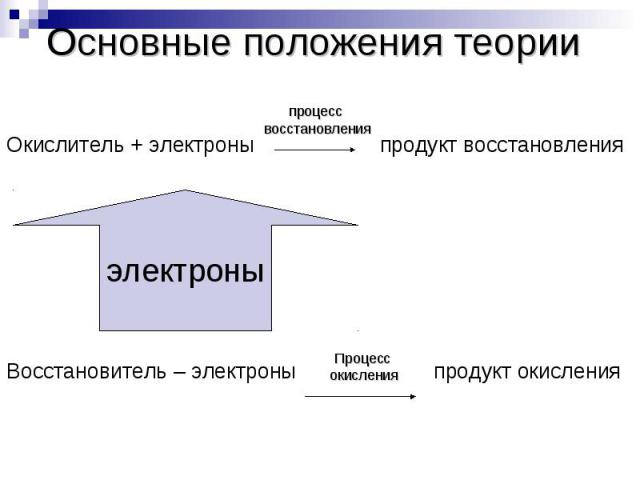
Основные положения теорииОкислитель + электроны продукт восстановленияВосстановитель – электроны продукт окисления
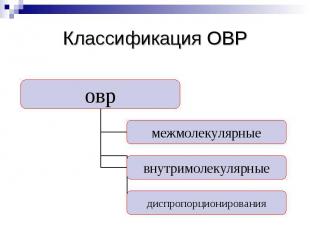
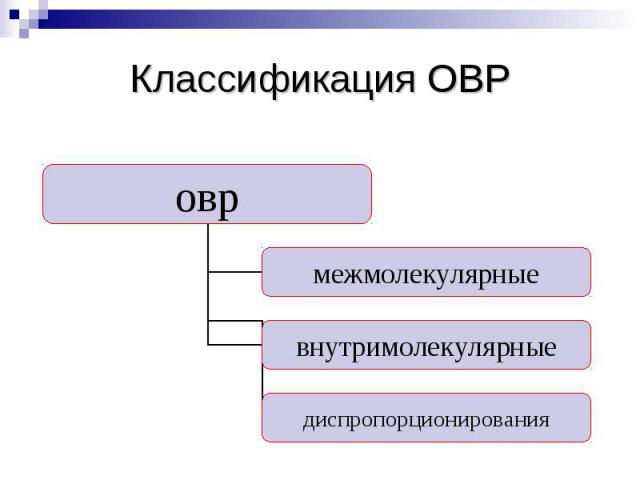
Классификация ОВР

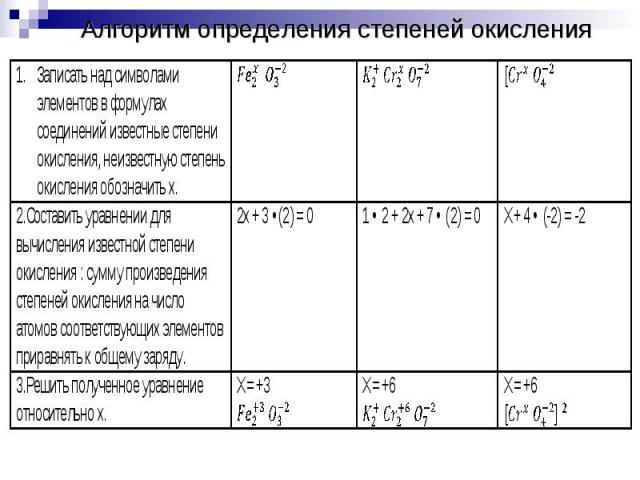
Определить степени окисления элементов в соединениях, участвующих в реакции.Выявить элемент, степень окисления которого понизилась, повысилась, окислитель и восстановитель.Выявить число отданных и принятых электронов.

Число отданных и принятых электронов должно быть одинаковым. Если это не так, то составить электронный баланс:Найти НОК числа отданных и принятых электронов;Делением НОК на число отданных и принятых получить коэффициент перед восстановлением;Делением НОК на число принятых электронов получить коэффициент перед окислением;Умножить полуреакции окисления и восстановления на соответствующие коэффициенты.Перенести коэффициенты в общее уравнение.
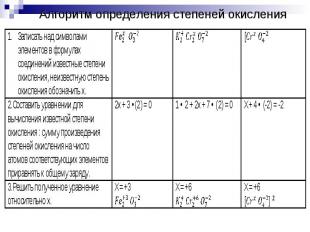
Алгоритм определения степеней окисления

Восстановитель

ЭЭ n+Атомы металлов (I и II гр., Al, Fe, Zn…).Отрицательно заряженные ионы неметаллов (S2–, Cl –, Br –… до свободных элементов).Ионы металлов в низких степенях окисления (Mn2+ Mn1+).Ионы и молекулы, содержащие атомы в промежуточных степенях окисления (бисульфит).

Окислитель

ЭЭ n-Атомы элементов VI–VII групп (О2, Сl2…).Ионы металлов в высоких степенях окисления (Cu2- Cu+) Ионы молекул содержат атомы неметаллов в высоких степенях окисления (КМnО4 – Mn7+).Ионы и молекулы, содержащие атомы неметаллов в высоких степенях окисления.

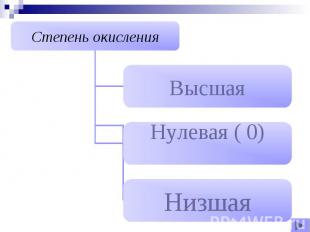
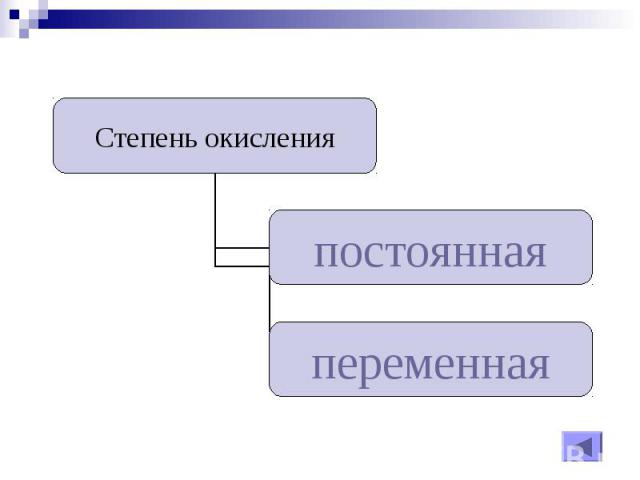
Степень окисления – Условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения только ионные.

Сера (-2,0,+2,+4,+6)

Характерна для Ме и нМеХарактерна для Ме и нМеОпределяем по номеру группы?
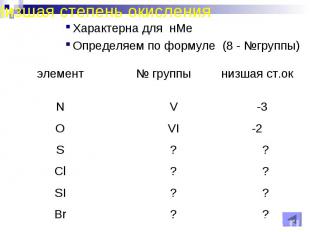
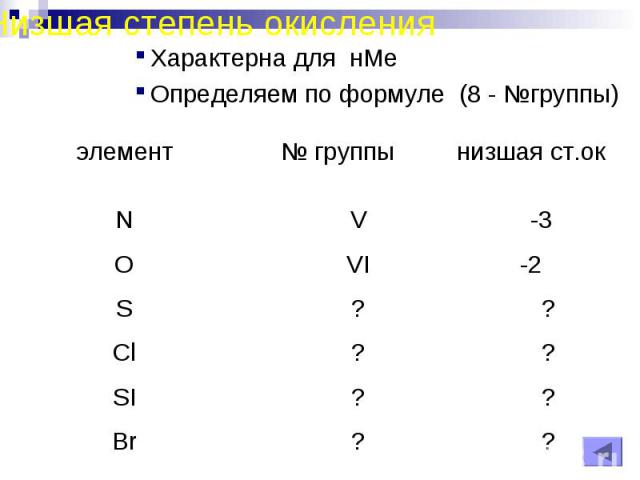
Низшая степень окисленияХарактерна для нМеОпределяем по формуле (8 - №группы)

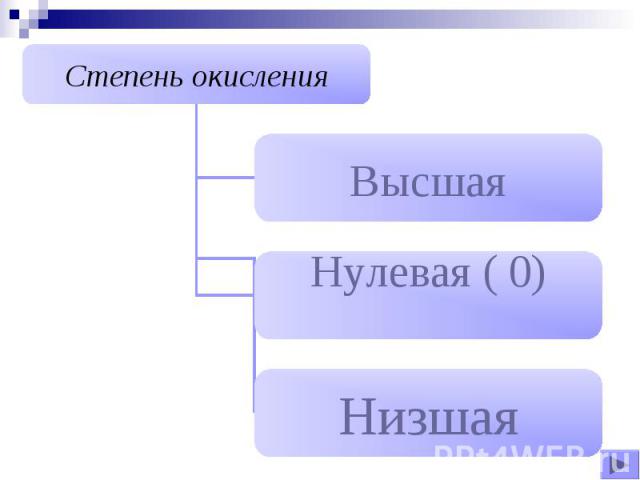
Нулевая ( 0)Все простые вещества


Тест для 8 классаТема: «Окислительно – восстановительные реакции»

Инструкция по выполнению тестаВнимательно прочитайте задание и выберите правильный ответ – нажмите справа на нужную кнопкуВремя тестирования ограничено: 10 минут

Степень окисления серы K2SO3 в равна

Окислительно - восстановительная реакцияCaO+Co2=CaCO3NaOH+HCl=NaHCl+H2OFe+CuSO4=FeSO4+CuNa3SiO3+2HCl=2NaCl+H2SiO3

Принимает электроныОкисляетсяОтдаёт электроныНе изменяет степень окисления

Магний имеет минимальное значение степени окисления

Фтор имеет максимальное значение степени окисления

Молодец!Справились верно с 5 заданиямиОтличная работа!

Вы ответили неправильно!Прочитайте параграф 43 ещё раз.Выполните тестовое задание снова.Вернуться на тестовое задание