Презентация на тему: Первые попытки классификации химических элементов
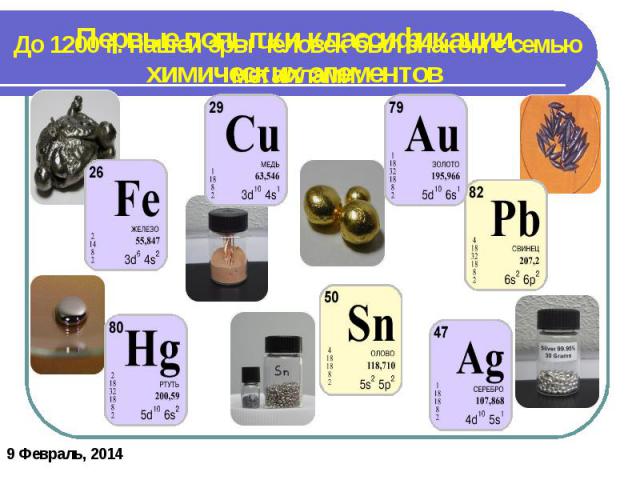
Первые попытки классификации химических элементов До 1200 г. нашей эры человек был знаком с семью металлами:

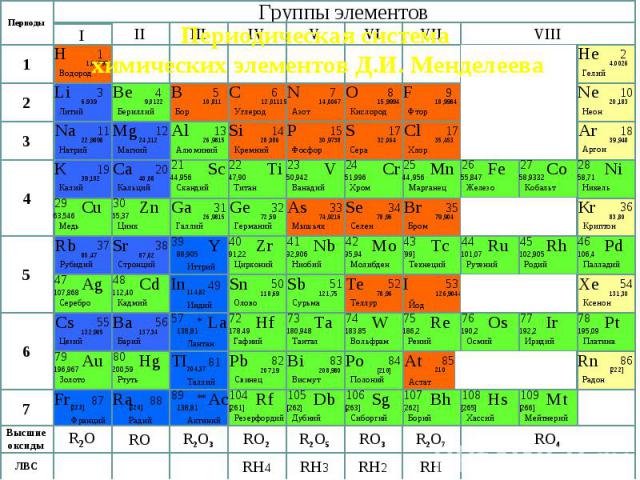
Но наука никогда не стоит на месте:В середине XIX века было известно уже 63 химических элемента.Учёных – химиков того времени волновал вопрос:«Как классифицировать известные химические элементы?»

Классификация химических элементов на: металлы и неметаллыОбщие свойства металлов: Пластичность – способность изменять свою форму при ударе, прокатываться в тонкие листы, вытягиваться в проволоку.Электропроводность – способность проводить электрический ток.Теплопроводность – способность проводить теплоМеталлический блеск – хорошо отражают световые лучи.Твердое агрегатное состояние (кроме ртути)

Какими признаками обладают указанные вещества?Вывод: классификация элементов на металлы и неметаллы – не верна!

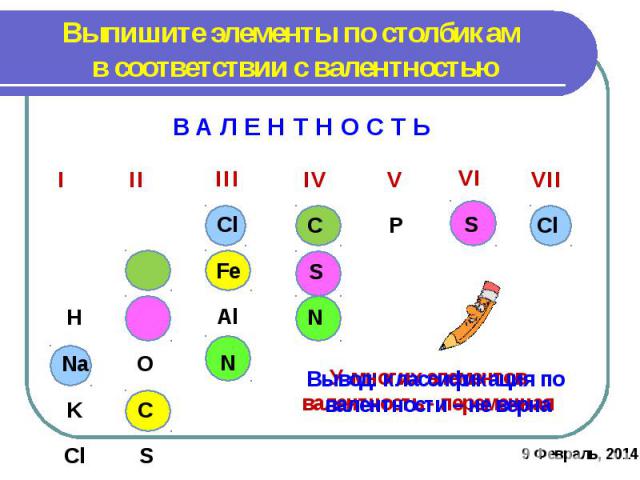
Определить валентность элементов I II I II VI II III I IV I I II H2O Na2O SO3 NH3 CH4 K2S II II IV II III II II II I I III IIMgO NO2 Cl2O3 CO HCl Fe2O3 III II V II IV II VII II II IIAl2O3 P2O5 SO2 Cl2O7 FeO
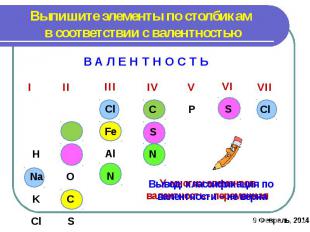
Выпишите элементы по столбикам в соответствии с валентностьюВ А Л Е Н Т Н О С Т ЬВывод: классификация по валентности – не верна

Определить валентность элементовCBr4 N2O HF PH3 SiO2 Al2S3 Mg3P2 CaO; H2S; Cr2O3 SBr4 Na3N Cu2O AlF3Al4C3 PCl5 SiO2 Cl2O5 CaBr2 Li3N CO
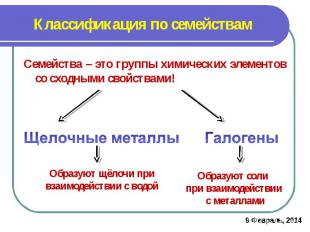
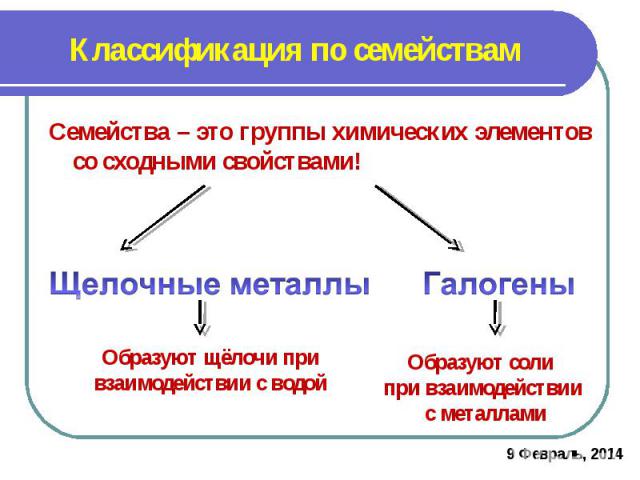
Классификация по семействамСемейства – это группы химических элементов со сходными свойствами!
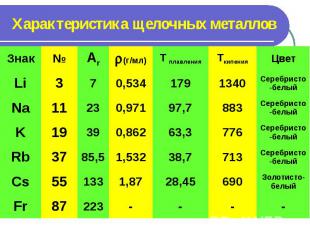
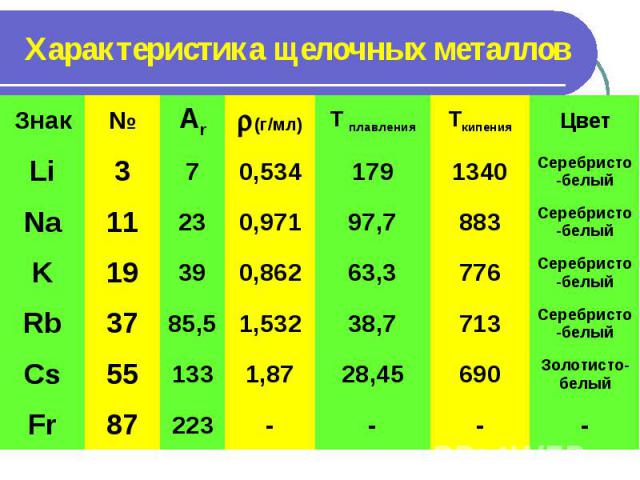
Характеристика щелочных металлов

Щелочные металлы – простые вещества

Взаимодействие щелочных металлов с водой
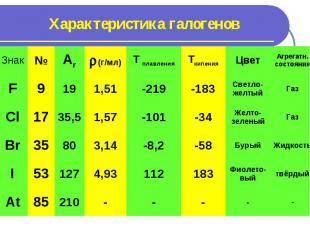
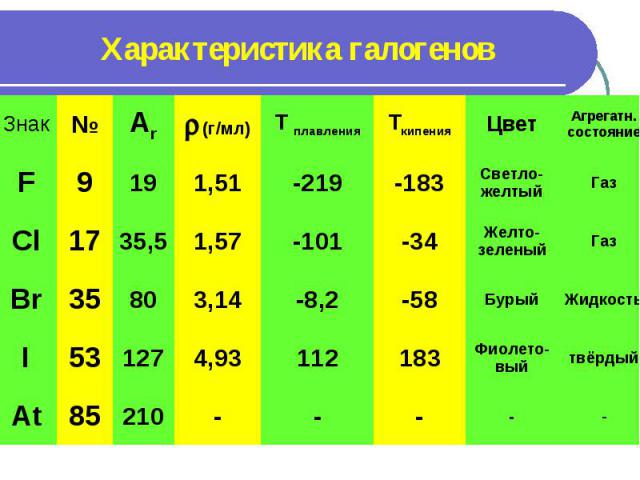
Характеристика галогенов

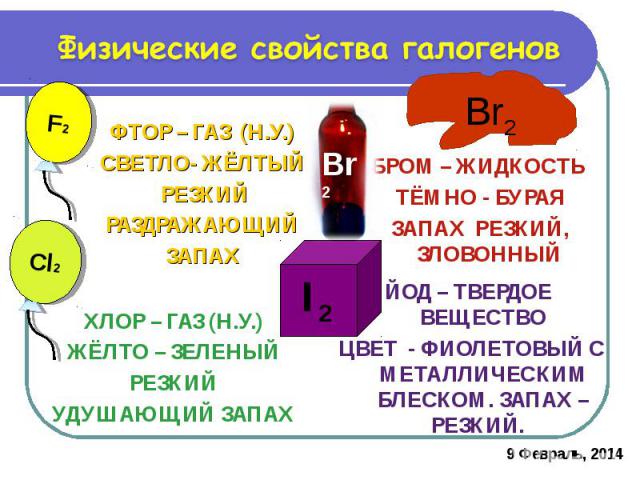
Физические свойства галогеновФТОР – ГАЗ (Н.У.)СВЕТЛО- ЖЁЛТЫЙ РЕЗКИЙРАЗДРАЖАЮЩИЙЗАПАХХЛОР – ГАЗ (Н.У.) ЖЁЛТО – ЗЕЛЕНЫЙ РЕЗКИЙУДУШАЮЩИЙ ЗАПАХБРОМ – ЖИДКОСТЬ ТЁМНО - БУРАЯЗАПАХ РЕЗКИЙ, ЗЛОВОННЫЙ ЙОД – ТВЕРДОЕ ВЕЩЕСТВОЦВЕТ - ФИОЛЕТОВЫЙ С МЕТАЛЛИЧЕСКИМ БЛЕСКОМ. ЗАПАХ – РЕЗКИЙ.

Возгонка йодаВозгонка – это переход вещества из твердого агрегатного состояния в газообразное, минуя жидкое.

Повторение:1. Расставьте коэффициенты в следующихуравнениях реакций. Определите типы реакций:СаСО3 → СаО + CO2Na2SO4 + ВаСl2 → NaСl + ВаSO4SO3 + H2O → H2SO4Cu(OH)2 + HNO3 → Cu(NO3)2 + H2OFe(OH)3 → Fe2O3 + H2OАl2(SO4)3 + NaOH → Na2SO4 + Аl(OH)3↓

Повторение2. Напишите уравнения реакций по названиям исходных веществ и продуктов реакций. Определите типы реакций.А) Сульфат магния + гидроксид натрия → гидроксид магния + сульфат натрия.Б) Хлорид калия + нитрат серебра → нитрат калия + хлорид серебра.В) Железо + соляная кислота → хлорид железа (II) + водород.Г) Оксид меди + оксид азота (V) → нитрат меди (II)Д) Железо + сера → сульфид железа (II).