Презентация на тему: Одноатомные спирты

Одноатомные спирты

СПИРТЫ И ФЕНОЛЫ Спиртами называются соединения, содержащие одну или несколько гидроксильных групп (–ОН), связанных с углеводородным радикалом. Вещества, у которых гидроксил находится непосредственно у бензольного кольца, называются фенолами. В зависимости от числа гидроксильных групп спирты делят на одно-, двух- и трёхатомные. В зависимости от того, при каком углеродном атоме находится гидроксильная группа, различают спирты:первичные R–CH2–OH, вторичные Rи третичные R I I CH–OH, R’ - C–OH I I R’ R’’

Физические свойства Низшие спирты (до С12) – жидкости, температуры кипения которых значительно выше, чем у соответствующих алканов из-за образования водородных связей за счёт полярной связи О–Н O–H ….. :O–H …… I I R R Метанол и этанол смешиваются с водой в любых соотношениях; с увеличением молекулярной массы растворимость спиртов в воде уменьшается.

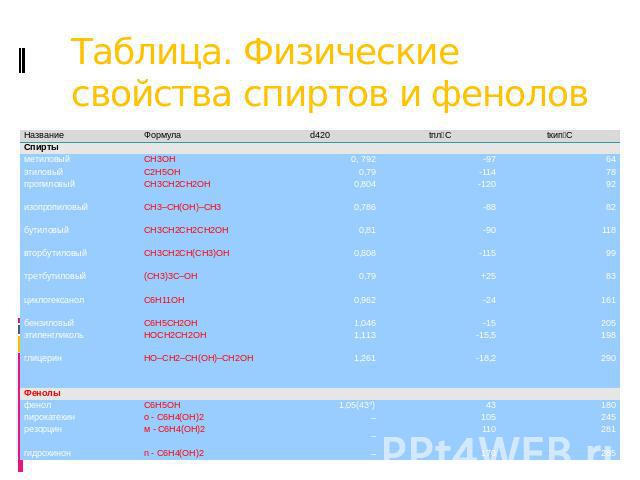
Таблица. Физические свойства спиртов и фенолов

Одноатомные спирты Изомерия Изомерия углеродного радикала (начиная с C4H9OH). Изомерия положения гидроксильной группы, (начиная с С3Н7ОН). Межклассовая изомерия с простыми эфирами (СН3–СН2–ОН и СН3–О–СН3). Название спиртов включает в себя наименование соответствующего углеводорода с добавлением суффикса -ол (положение гидроксильной группы указывают цифрой) или к названию углеводородного радикала добавляется слово "спирт"; также часто встречаются тривиальные (бытовые) названия: СН3–ОН – метанол, метиловый спирт;СН3–СН2–ОН – этанол, этиловый спирт;СН3–СН–СН3 – пропанол-2, изопропиловый спирт. I OH

Получение В промышленности. Метанол синтезируют из синтез-газа на катализаторе (ZnO, Сu) при 250C и давлении 5-10 МПа: СО + 2Н2 СН3ОН Ранее метанол получали сухой перегонкой древесины без доступа воздуха. Этанол получают: гидратацией этилена (Н3РО4; 280C; 8 МПа) СН2=СН2 + Н2О СН3–СН2–ОН брожением крахмала (или целлюлозы): крахмал С6Н12О6(глюкоза) ––ферменты 2С2Н5ОН + 2СО2(источник крахмала – зерно, картофель)

В лаборатории. Гидратация алкенов (согласно правилу В.В. Марковникова): СH3–СH=CH2 + H2O ––H+ СH3–CH– СH3 I OH Гидролиз галогенопроизводных углеводородов: СH3–СH2–Br + H2O СH3–CH2–OH + HBr Чтобы сдвинуть равновесие вправо, добавляют щёлочь, которая связывает образующийся HBr.

Восстановление карбонильных соединений: Альдегиды образуют первичные спирты, а кетоны – вторичные. O II СH3–СH2 – C ––2[H] СH3–CH2CH2–OH I H СH3-- C --CH3 ––2[H] CH3--CH--СH3 II I O OH
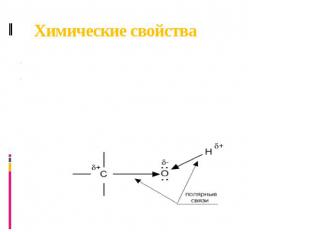
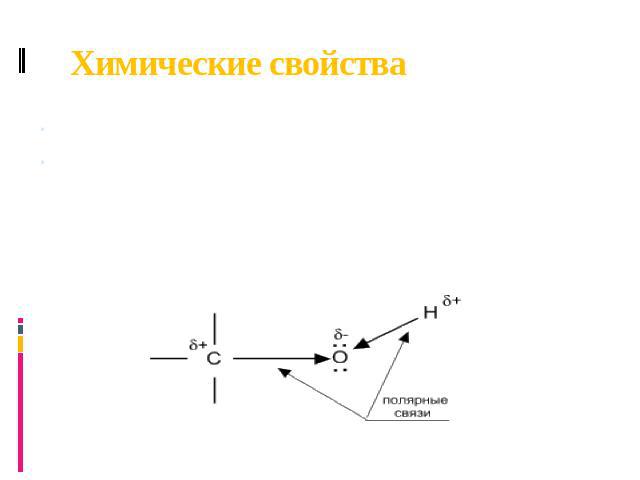
Химические свойства Свойства спиртов ROH определяются наличием полярных связей O-–H+ и C+–O-, и неподеленных электронных пар на атоме кислорода. При реакции спиртов возможно разрушение одной из двух связей: C–OH (с отщеплением гидроксильной группы) или O–H (с отщеплением водорода). Это могут быть реакции замещения, в которых происходит замена OH или H, или элиминирование (отщепление), когда образуется двойная связь. На реакционную способность спиртов большое влияние оказывает строение радикалов, связанных с гидроксильной группой.

Реакции с разрывом связи RO–H Спирты реагируют с щелочными и щелочноземельными металлами, образуя солеобразные соединения – алкоголяты. Со щелочами спирты не взаимодействуют. 2СH3CH2CH2OH + 2Na 2СH3CH2CH2ONa + H2 2СH3CH2OH + Сa (СH3CH2O)2Ca + H2 В присутствии воды алкоголяты гидролизуются: (СH3)3С–OK + H2O (СH3)3C–OH + KOH Это означает, что спирты – более слабые кислоты, чем вода.

Реакция этерификации Взаимодействие с органическими кислотами приводит к образованию сложных эфиров. O O II II CH3–C--OH + H --OC2H5 H2SO4 CH3–C–O–C2H5 + H2O (уксусноэтиловый эфир (этилацетат)) В общем виде: O O II H+ II R–C--OH + H--OR’ R–C–O–R’ + H2O

Реакции с разрывом связи R–OH. С галогеноводородами: R–OH + HBr R–Br + H2O С концентрированной серной кислотой: C2H5O--H + H–O O C2H5O O \ // \ // S S (этилсерная кислота) + H2O / \\ / \\ H–O O H–O O C2H5–O O C2H5O O \ // \ // S S (диэтилсерная кислота(диэтилсульфат)) + H2O / \\ / \\ C2H5O-H+ H–O O C2H5O O

Реакции окисления Спирты горят: 2С3H7ОH + 9O2 6СO2 + 8H2O При действии окислителей: первичные спирты превращаются в альдегиды (или в карбоновые кислоты)
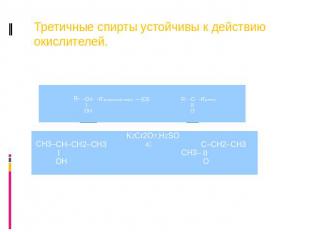
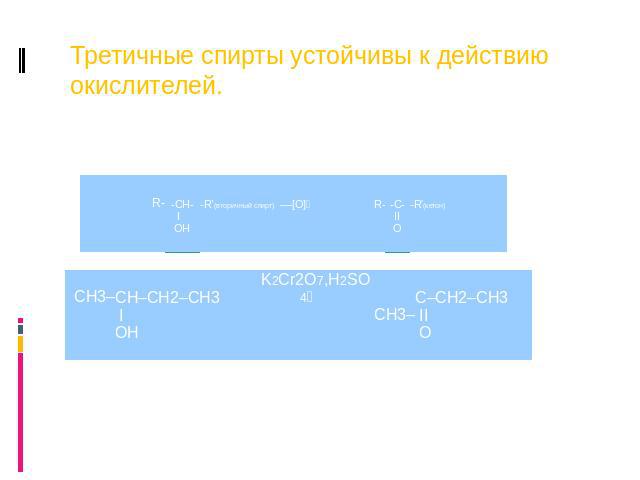
Третичные спирты устойчивы к действию окислителей.

Дегидратация Внутримолекулярная дегидратация приводит к образованию алкенов CH3–CH2–OH ––t>140C,H2SO4 CH2=CH2 + H2O При отщеплении воды от молекул вторичных и третичных спиртов атом водорода отрывается от соседнего наименее гидрогенизированного атома углерода; образующийся алкен содержит наибольшее число заместителей при двойной связи (правило Зайцева).

Межмолекулярная дегидратация даёт простые эфиры R--OH + H--O–R –– t,H2SO4 R–O–R(простой эфир) + H2O CH3–CH2--OH + H--O–CH2–CH3 ––t<140C,H2SO4 CH3–CH2–O–CH2–CH3(диэтиловый эфир) + H2O Обе реакции конкурируют между собой. Увеличение температуры и разбавление инертным растворителем благоприятствуют внутримолекулярному процессу.







![Восстановление карбонильных соединений: Альдегиды образуют первичные спирты, а кетоны – вторичные. O II СH3–СH2 – C ––2[H] СH3–CH2CH2–OH I H СH3-- C --CH3 ––2[H] CH3--CH--СH3 II I O OH Восстановление карбонильных соединений: Альдегиды образуют первичные спирты, а кетоны – вторичные. O II СH3–СH2 – C ––2[H] СH3–CH2CH2–OH I H СH3-- C --CH3 ––2[H] CH3--CH--СH3 II I O OH](/images/150/8282/640/img7.jpg)