Презентация на тему: Химическая связь

Химическая связь Лектор Мирошниченко Юлия Юрьевна 900igr.net

План лекции - Природа химической связи и её характеристики - Типы химических связей - Основные теории хим. связи - ковалентная связь, метод ВС - гибридизация АО метод МО ионная связь

Химическая связь–электростатич. взаимодействие связывающее атомы в ионы, молекулы, кристаллы Основное условие - понижение полной энергии многоатомной системы по сравнению с энергией изолированных атомов Пример: А + В = АВ, ЕАВ EA + EB

Характеристики связи

Длина химической связи (l св) - расстояние между ядрами атомов в соед-ях В однотипных соед-ях длина связи закономерно изменяется: HF – HCl – HBr – HI длина связи возрастает

Энергия связи (Есв) – это энергия, выделяющаяся при образовании хим. связи или расходуемая на её разрыв Взаимосвязь Есв и lсв: Молекула HF HCl HBr HI lсв, нм 0,092 0,128 0,142 0,162 Есв 566 432 366 298 кДж/моль

Валентный угол образован воображаемыми линиями, соединяющими центры взаимодействующих атомов O Cl — Be — Cl H H α = 180O α = 104,5O

Дипольный момент – колич-ная характеристика полярности связи (измеряется в дебаях) μ = q lдип q– заряд полюса [Кл] lдип – длина диполя [м] Дебай (D):1D = 3,33.10-3 Кл м [Кл м ]

Дипольный момент – векторная величина, направленная от (+) к (–) Различают дип. моменты хим. связи и молекул μмол. = μсв

Для хар-ки диполя, исп-ют эффективный заряд qэфф и длину диполя l В 1-м случае принимают l = d межъядерному расстоянию Во 2-м, заряд равен заряду эл-на, а длину определяют как эфф-ую величину эксп d qэфф = эксп q lэфф=

Типы химических связей Распределение электронной плотности между взаимод-ми атомами определяет тип химической связи: ковалентная ионная металлическая

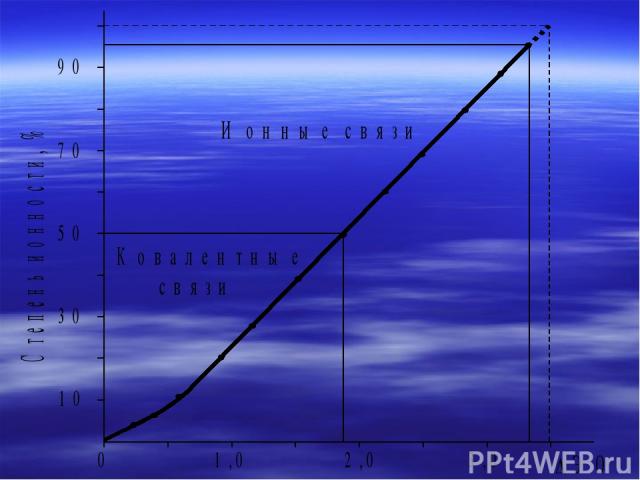
А : А = 0 Ковалентная неполярная связь А : В 0 Ковалентная полярная связь А-: С+ 1,9 Ионная связь евал (общие для всех атомов) - Металлическая связь Во многих веществах реализуются одновременно несколько типов химической связи

Полярная и неполярная ковалентная связь Полярная ковалентная связь Неполярная ковалентная связь

Основные теории химической связи Гравитационная теория Бергмана – Бертолле Электрохимическая теория Берцелиуса (1810) Формалистическая теория типов Дюма - Жерара Учение о химическом строении вещества А.М. Бутлерова(1861) Ковалентная теория Льюиса (1914) Ионная теория Косселя (1916)

Ковалентная связь Для объяснения механизма образования ковалентной хим. связи разработано несколько методов Наиболее применимые: - метод валентных связей(ВС) - метод молекулярных орбиталей (МО)

Метод валентных связей (ВС) Связанные между собой атомы в молекуле удерживаются вместе при помощи одной или нескольких общих эл-ных пар Химическая связь между двумя атомами локализована в месте перекрывания атомных орбиталей (локализованная двухцентровая связь)

Научное объяснение гипотезы дано В. Гейтлером и Ф. Лондоном (1927) путем приближенного решения уравнения Шредингера для молекулы водорода Гипотеза образования ков. связи за счет обобществления эл-нов дана Льюисом
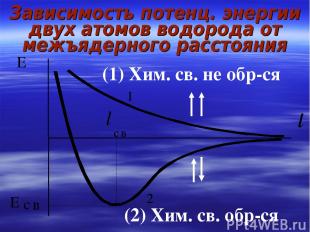
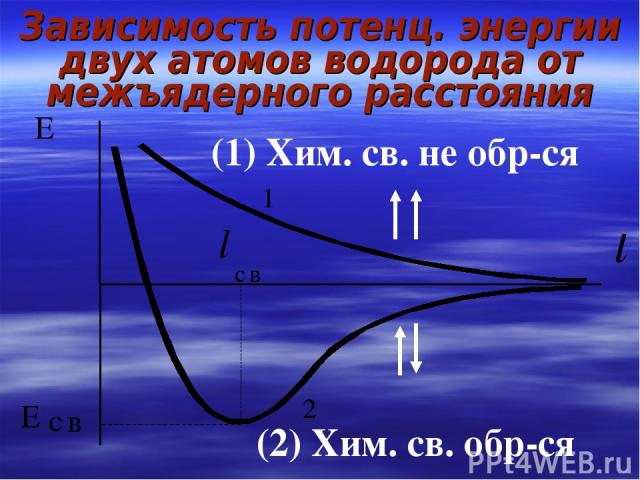
Зависимость потенц. энергии двух атомов водорода от межъядерного расстояния (1) Хим. св. не обр-ся (2) Хим. св. обр-ся

Метод ЛКАО Находят многоцентровые волновые функции мол, которые описывают движение электронов в молекуле Основа метода: молекулярные волновые функции строят комбинируя волновые функции АО: С1, С2,..Сn - коэффициенты Лучшая мол отвечает Еmin.

Обменный механизм образования ковалентной связи Общие пары электронов образуются при спаривании неспаренных эл-нов, принадлежащих разным атомам При этом число неспаренных электронов у многих атомов ув-ся за счет расспаривания спаренных электронов, если на вал. уровне есть свободные орбитали Этот процесс является переходом атома в возбужденное состояние


Донорно-акцепторный механизм образования связи связывающие эл-ные пары образ-ся объединением пары вал. электронов одного атома (донора) со свободной АО другого атома (акцептора) Пример: BF3 + F – = BF4– B F

Основные положения метода ВС Ков. связь образуют два электрона с противоположными спинами, принадлежащие двум атомам При образовании связи происходит перекрывание АО и увеличение электронной плотности между ними, что приводит к уменьшению энергии Связь реализуется в направлении наибольшего перекрывания АО

Валентность определяется числом неспаренных электронов Пример: атом Н (1s1) - валентность равна 1 атом Не (1s2) - валентность равна 0 валентность может быть увеличена - промотированием атома - донорно-акцепторным взаимод.

Свойства ковалентной связи

Направленность хим. связи обусловлена перекрыванием электронных облаков определяется направленностью в пространстве АО с l 0 Атомные орбитали px-, py- и pz- расположены под углами 900 d- орбитали: лепестки образуют угол 900, а между различными d- АО могут быть углы 1800, 900 и 450

Насыщаемость – макс. возможное число связей, определяемое общим числом задействованных орбиталей 1-й период - макс. валентность = 1 2-й период - макс. валентность = 4, т.к. валентные 4 АО (2s- и три 2р) 3-й период - валентные 9 АО (3s, три 3р и пять 3d), но макс. валентность практически не реализуется

Кратность хим. связи - число общих электронных пар, реализующих связь между двумя атомами Чем выше кратность связи, тем она прочнее (кратности больше 3 не бывает) Кратность обусловлена характером перекрывания АО Молекула F2 O2 N2 Кратность связи 1 2 3 Е св, кДж/моль 159 494 945

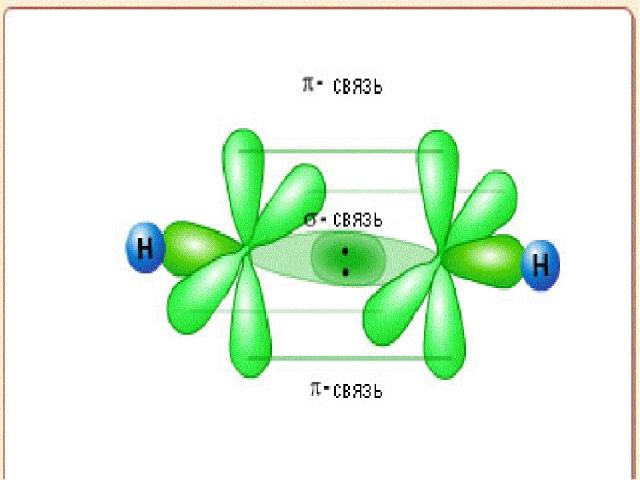
Типы перекрывания атомных АО -взаимодействие возникает при перекрывании орбиталей s – s и s – p, p – p, d – d вытянутых вдоль одной оси - взаимодействие, перекрывание по линии, перпендикулярной линии связи В молекуле N2 - тройная связь (1 - и 2 -)

Типы перекрывания атомных АО - (дельта) взаимодействие, при которой перекрываются d-орбитали четырьмя лепестками По прочности хим. взаимодействия располагаются в следующей ряд: σ > π > δ π и δ – взаимод-вия возникают как дополнительные к - взаимод-вию
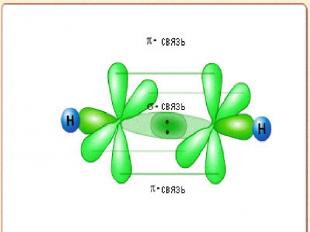
H C C H

Гибридизация АО Атом, взаимодействуя с несколькими одинаковыми партнерами, образует равнопрочные связи с участием электронов разных уровней. Кроме того, углы между связями в подобных многоатомных молекулах не те, которые следовало бы ожидать из пространственного расположения взаимодействующих АО. Пример: в H2O – 104,50, в NH3 – 1070, в CH4 – 109,280 и т. д. Для объяснения этих противоречий в теорию введено представление о гибридизации АО, т.е. о перемешивании орбиталей с различными квантовыми числами и получением гибридных АО.

Гибридизация АО Это мат-ий прием отыскания новых волновых функций, удовлетворяющих условию равнопрочности образуемых связей и уменьшению энергии гибр = Сs s ± Сp p При этом из двух «чистых» АО ( s и р) обр-ся две гибридные: гибр1=Сs s + Сp p гибр2=Сs s – Сp p

Основные положения гибридизации Гибридизуются орбитали атома, реализующего связи с другими атомами Гибридизуются АО с близкой энергией Число гибридных орбиталей равно суммарному числу исходных орбиталей Гибридизация сопровождается изменением формы электронных облаков, поэтому хим. связи с участием гибр. орбиталей обладают большей прочностью, чем связи с “чистыми” АО
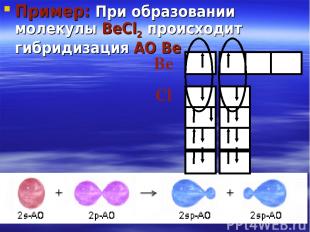
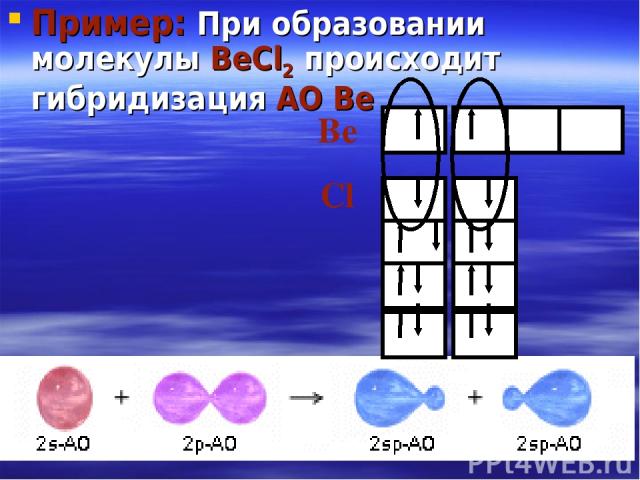
Пример: При образовании молекулы BeCl2 происходит гибридизация АО Be Be Cl

Другие типы гибридизации sp3 гибридизации АО атома С в СН4
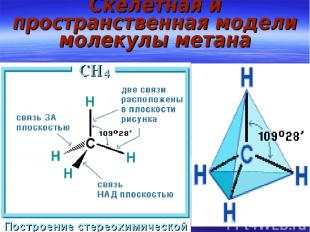
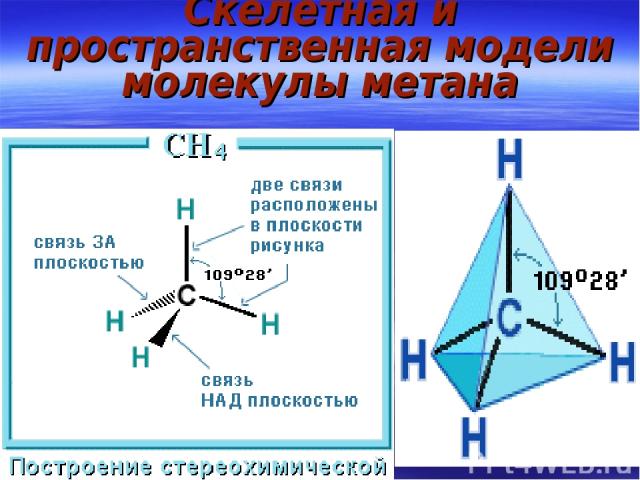
Скелетная и пространственная модели молекулы метана

Слабые стороны метода ВС Не допускает присутствия в мол-х неспаренных электронов Не объясняет существования частиц – молекулярных катионов, в которых хим. связь осуществляется не парой, а одним электроном (H2+, Hе2+ ) Неожиданные параметры связи в молекулах и молекулярных ионах, вызванные переходами электронов

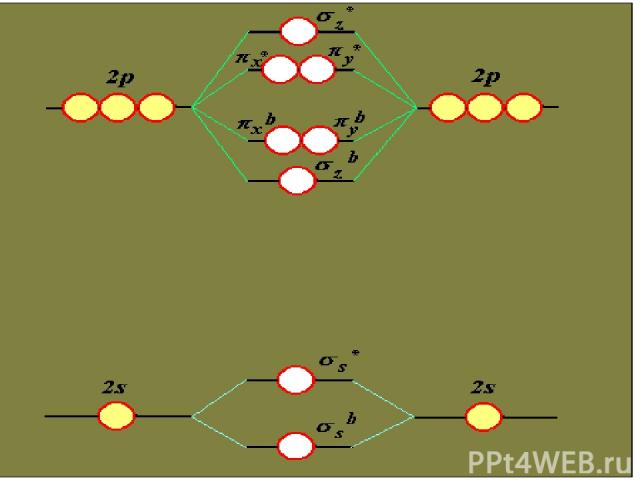
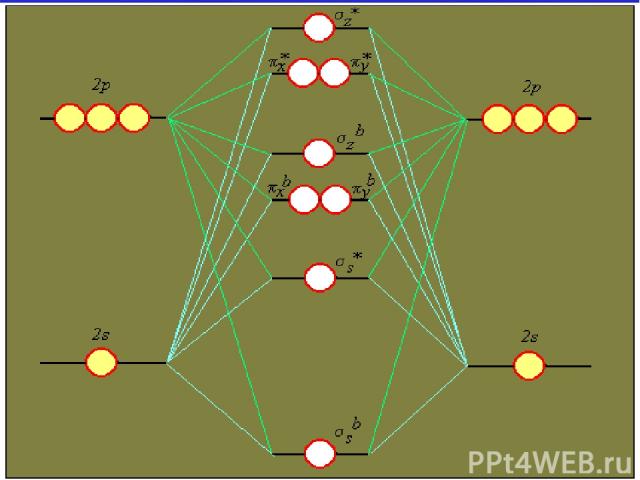
Основные положения метода МО МО - делокализованные и многоцентровые Состояние эл-нов в молекулах соот-вует принципам min энергии, Паули и Гунда Условия возникновения МО: - АО должны быть близкими по энергии -Атомные орбитали перекрываются - Расположение АО на линии связи должно быть одинаковым по симметрии - Из n АО образуется n МО - МО обозначают: , π, ,

Связывающие и разрыхляющие МО Для нахождения волновых функций МО используют ЛКАО Из двух перекрывающихся АО обр-ся две МО МОсв – min эн-ия МОр – max эн-ия

Модель образования св и р МО р МО св s AO s AO
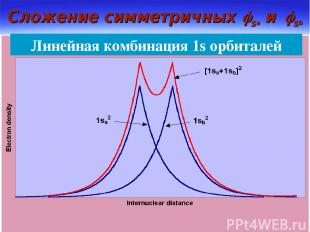
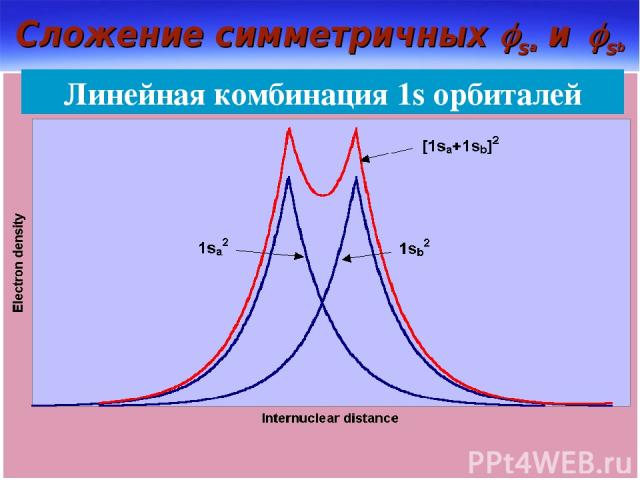
Сложение симметричных sa и sb Линейная комбинация 1s орбиталей
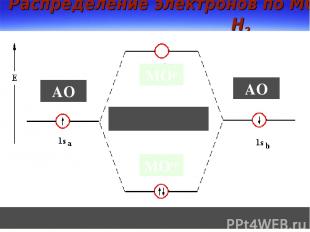
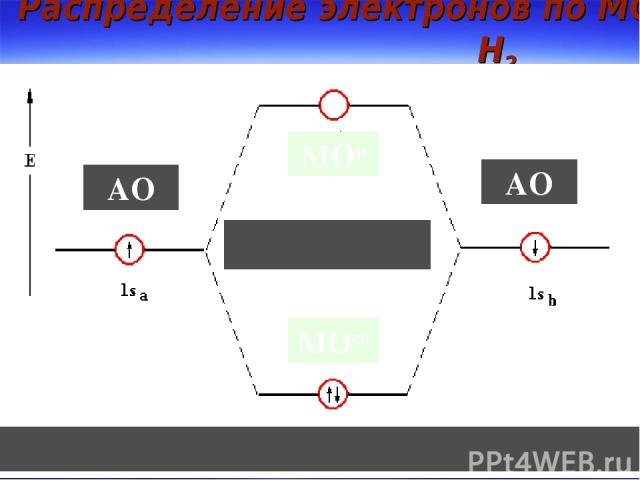
Распределение электронов по МО в Н2 МОр МОсв АО АО

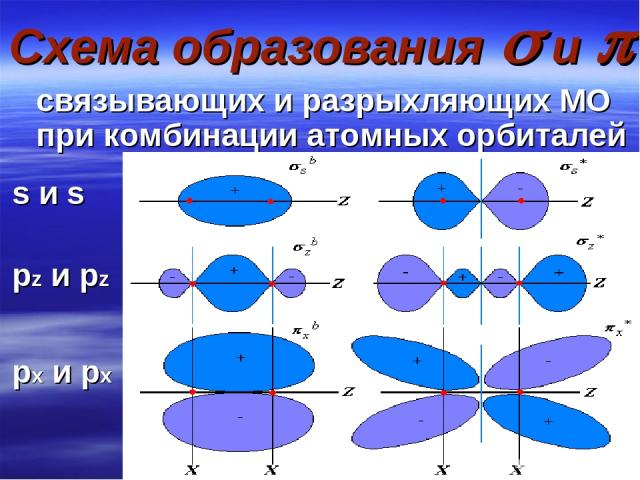
Схема образования и связывающих и разрыхляющих МО при комбинации атомных орбиталей s и s pz и pz px и px
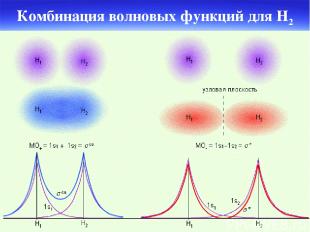
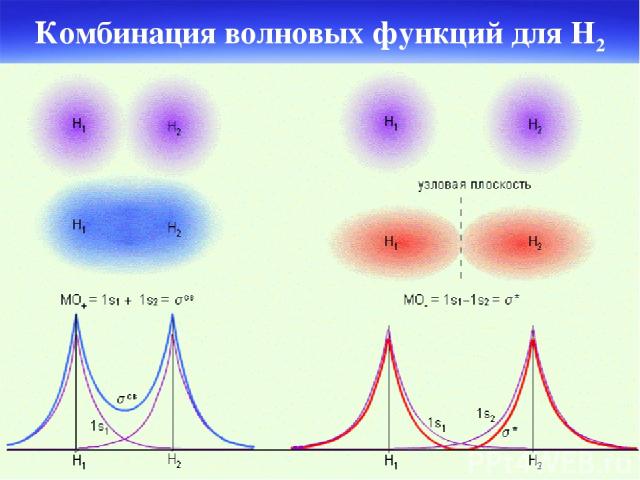
Комбинация волновых функций для H2
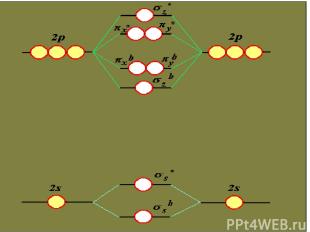
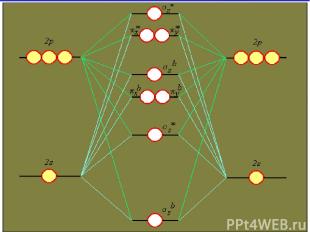

Ионная связь Энергия связи определяется силами электростатического взаимодействия противоположно заряженных ионов Ионные соединения состоят из огромного числа ионов, связанных в одно целое силами электростатического притяжения

Цикл Габера-Борна Нf = Еион(К) - Fср(А) + Uреш+ Нсуб(К)+ 1/2Едис(А2) Для NaCl Uреш= 412 + 109 + 121 – 368 + 494 = 768 кДж моль

Энергия кулоновского взаимодействия - коэф-т отталкивания

В ионном кристалле учитывается взаим-ие со всеми остальными частицами Взаимодействие увеличивается в М раз, это учитывает коэффициент Маделунга, зависит только от структуры кристалла Для решетки типа NaCl М = 1,7476

Энергия кристаллической решетки энергия разрушения решетки на ионы _Екул = Uреш. Екул находят по формуле Капустинского

Цикл Габера-Борна Нf=-Еион(К)+Fср(А)-Uреш - - Нсуб(К)-Едис(А2) Для NaCl Uреш= 109 + 412 + 494 + 121 – 368 = 768 кДж моль

Характеристики ионной связи энергия кристаллической решетки эффективный заряд радиус иона координационные числа ионов

Uреш. возрастает с увеличением заряда ионов и уменьшением их радиусов Uреш - такого же порядка величина, что и энергия ковал. связи Это объясняет прочность многих ионных кристаллов, их высокие температуры плавления и кипения
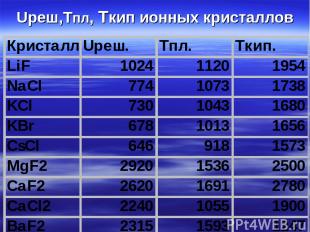
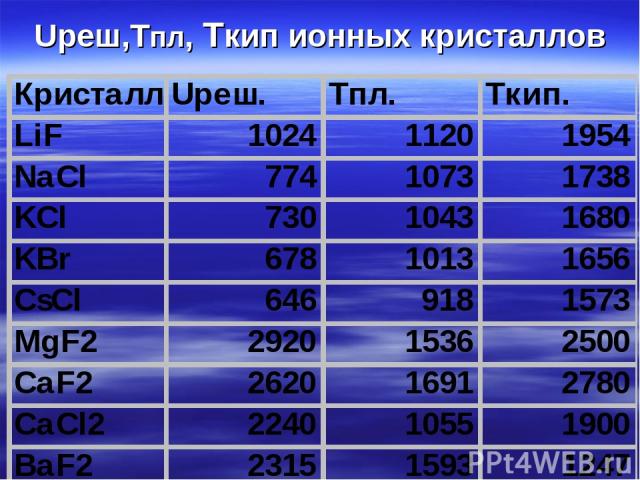
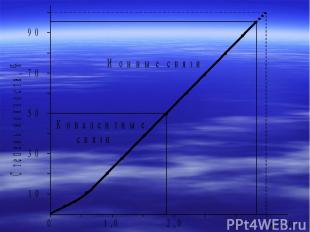
Uреш,Тпл, Ткип ионных кристаллов

Эффективный заряд иона - это реальный заряд иона в кристаллической структуре Рентгеновский метод определяет заряд атома, при сравнении спектра свободного атома и в соединении Исследование диэлектрической проницаемости в кристаллах дает эффективные заряды атомов в ряде соединений
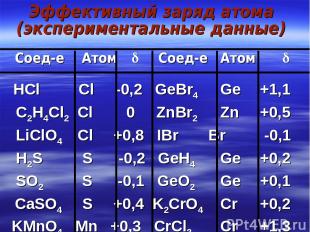
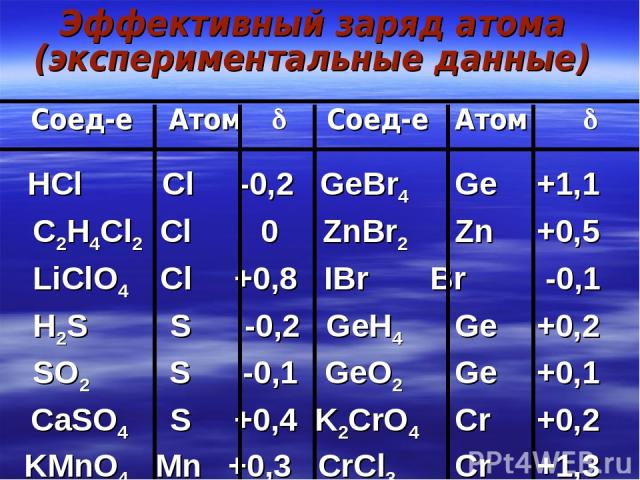
Эффективный заряд атома (экспериментальные данные) Соед-е Атом Соед-е Атом HCl Cl -0,2 GeBr4 Ge +1,1 C2H4Cl2 Cl 0 ZnBr2 Zn +0,5 LiClO4 Cl +0,8 IBr Br -0,1 H2S S -0,2 GeH4 Ge +0,2 SO2 S -0,1 GeO2 Ge +0,1 CaSO4 S +0,4 K2CrO4 Cr +0,2 KMnO4 Mn +0,3 CrCl3 Cr +1,3

Степень ионности (i) это реальный заряд иона в крист-й структуре Величина ионности может быть оценена и по разности электроотрицательностей атомов

Эффективный радиус - это радиус действия иона в кристалле Находят по r ионов в кристалле (r ионов не одинаковы и радиус одного из ионов необходимо определить) Оптическим методом был получен r(F-) = 1,33·10 10 нм зная межъядерное расстояние в кристалле NaF (d = 2,31·10 10 нм) нашли r(Na+) = ( 2,31-1,33) ·10 10= 0,98 нм

Структура ионных молекул и кристаллов опр-ся зарядами ионов и их размерами Ионные молекулы могут быть 2-х видов АВ и АВ2 т.к. степень ионности уменьшается с увеличением n (ABn)

Координационное число Cтруктура ионных кристаллов опр-ся координационным числом (К.ч.), которое зависит от отноcительных размеров ионов (rк/rа - числа Магнуса)

Свойства ионной связи

Ненаправленность и ненасыщаемость В ионном соединении каждый ион притягивает к себе независимо от направления неограниченное число противоположно заряженных ионов из-за сил электростатического взаимодействия Взаимное отталкивание противоионов ограничивает их число в окружении каждого иона

Ионные соединения при обычных условиях – твердые и прочные, но хрупкие вещества При плавлении и растворении в воде они распадаются на ионы (электролитическая диссоциация) и проводят электрический ток, т.е. являются электролитами

Поляризация Это влияние друг на друга ионов, приводящее к деформации электронных оболочек Причина - действие электрического поля, создаваемого соседними противоположно заряженными ионами В результате электронная оболочка смещается в сторону соседнего иона и деформируется

Поляризуемость - деформация электронного облака в электрическом поле Поляризующая способность - деформирующее влияние на другие ионы

Поляризуемость иона возрастает с ув-м размеров иона Li+ – Na+ – K+ – Rb+ – Cs+ F-– Cl-– Br-– I- радиус увеличивается поляризуемость возрастает rкат < rат < rан поэтому поляризуемость анионов выше поляризуемости катионов

Поляризующая способность ионов зависит от заряда, размера и типа иона Чем > заряд иона, тем > его поляризующее действие При одном и том же заряде напряженность электрического поля вблизи иона тем >, чем < его размеры

Катионы d-эл-тов обладают (при одном и том же заряде и близком радиусе) большей поляризующей способностью, чем катионы s- и p-элементов Анионы характеризуются поляризуемостью, а катионы поляризующей способностью

Влияние поляризации на свойства соединений: растворимость термическую устойчивость окраску

Пример AgCl хуже растворим в воде, чем NaCl и KСl Причина более сильное поляризующее действие Ag+ на Cl– и связи становятся более ковалентны в AgCl, что ухудшает его растворимость в воде

Пример: Кислородсодержащие к-ты менее устойчивы при нагревании, чем их соли Причина - сильное поляризующее действие Н+ Внедряясь в анион, протон снижает его заряд, ослабляет в нем хим. связи и делает его менее устойчивым, поэтому кислоты легко разлагаются на воду и оксид








![Дипольный момент – колич-ная характеристика полярности связи (измеряется в дебаях) μ = q lдип q– заряд полюса [Кл] lдип – длина диполя [м] Дебай (D):1D = 3,33.10-3 Кл м [Кл м ] Дипольный момент – колич-ная характеристика полярности связи (измеряется в дебаях) μ = q lдип q– заряд полюса [Кл] lдип – длина диполя [м] Дебай (D):1D = 3,33.10-3 Кл м [Кл м ]](https://fs3.ppt4web.ru/images/132073/184090/640/img7.jpg)