Презентация на тему: Химические реакции

Химические реакции Учебная презентация

Типы химических реакций По числу вступивших в реакцию веществ По тепловому эффекту По обратимости По изменению степени окисления По агрегатному состоянию веществ По механизму

По числу вступивших в реакцию веществ

По тепловому эффекту Экзотермические Идут с выделение теплоты S + O2 = SO2 + Q Эндотермические Идут с поглощением теплоты N2 + O2 = 2NO -Q

По обратимости Необратимые Идут только в одном направлении Условия: образование осадка или слабого электролита (Н2О), выделение газа, выделение большого количества теплоты Обратимые Идут одновременно в двух противоположных направлениях

По изменению степени окисления Идут без изменения степени окисления элементов CaCO3 = CaO + CO2 Окислительно – восстановительные реакции Идут с изменением степени окисления 2Na + Cl2 = 2NaCl
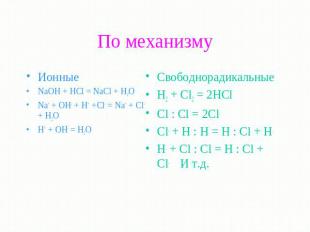
По механизму Ионные NaOH + HCl = NaCl + H2O Na+ + OH- + H+ +Cl- = Na+ + Cl- + H2O H+ + OH- = H2O Свободнорадикальные H2 + Cl2 = 2HCl Cl : Cl = 2Cl. Cl. + H : H = H : Cl + H. H. + Cl : Cl = H : Cl + Cl. И т.д.

По агрегатному состоянию веществ Гомогенные Между веществами нет поверхности раздела фаз H2 + Cl2 = 2HCl Гетерогенные Реакция идет на поверхности раздела фаз (т-г, т-ж, ж-г, т-т) С + О2 = СО2