Презентация на тему: Почему протекают химические реакции

11 класс Урок по темеПочему протекают химические реакцииСоставитель презентации – учитель химии МОУ СОШ им. А.С. ПоповаИванова И.Г.

Закон сохранения массы и энергии.Тепловой эффект химической реакции.Экзотермические и эндотермические реакции.Термохимия. Законы термохимии.Кто он Герман Гесс?Понятие об энтропии и энтальпии.Выводы по теме.

Почему протекают химические реакции Закон сохранения массы и энергии. Масса веществ, вступающих в реакцию равна массе веществ, образующихся в результате реакции.Закон сохранения массы дает материальную основу для составления уравнений химических реакций и проведения расчетов по ним.

Закон сохранения массы и энергии Взаимосвязь массы и энергии выражается уравнением Эйнштейна: E = mc2 где Е – энергия; m – масса; с – скорость света в вакууме.

Тепловые эффекты химических реакций нужны для многих технических расчетов. Представьте себя на минуту конструктором мощной ракеты, способной выводить на орбиту космические корабли и другие полезные грузы

Тепловые эффекты химических реакций. Химическая реакция заключается в разрыве одних и образовании других связей, поэтому она сопровождается выделением или поглощением энергии в виде теплоты, света, работы расширения образовавшихся газов.• И трещат сухие сучья, Разгораясь жарко,Освещая тьму ночнуюДалеко и ярко!И.Суриков

Классификация реакций По признаку выделения или поглощения теплоты реакции делятся на эндотермическиеэкзотермические

Реакции, протекающие с выделением теплоты, проявляют положительный тепловой эффект (Q>0, DH<0) и называются экзотермическими.С(тв) + 2 H2(г) = CH4(г) + 76 кДж/моль Реакции, которые идут с поглощением теплоты из окружающей среды (Q<0, DH>0), т.е. с отрицательным тепловым эффектом, являются эндотермическими.

Тепловой эффект химической реакции Количество теплоты, которое выделяется или поглощается в результате реакций между определенными количествами реагентовобычно обозначают символом Q.Q р = Q кон.- Q исх.
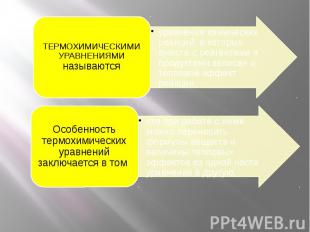
ТЕРМОХИМИЧЕСКИМИ УРАВНЕНИЯМИ называютсяуравнения химических реакций, в которых вместе с реагентами и продуктами записан и тепловой эффект реакции, Особенность термохимических уравнений заключается в том что при работе с ними можно переносить формулы веществ и величины тепловых эффектов из одной части уравнения в другую.

Раздел химии, занимающийся изучением превращения энергии в химических реакциях, называется ТЕРМОХИМИЕЙ. Существует два важнейших закона термохимии. Первый из них, закон Лавуазье–Лапласа, формулируется следующим образом:

закон Лавуазье–Лапласа Тепловой эффект прямой реакции всегда равен тепловому эффекту обратной реакции с противоположным знаком.

Второй закон термохимии был сформулирован в 1840 г российским академиком Г. И. Гессом:Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса.

Сульфат натрия Na2SO4 можно получить двумя путями из едкого натра NaOH. Первый путь (одностадийный): 2 NaOH + H2SO4 = Na2SO4 + 2 H2O + 131 кДж;Второй путь (двухстадийный):а) NaOH + H2SO4 = NaНSO4 + H2O + 62 кДжб) NaHSO4 + NaOH = Na2SO4 + H2O + 69 кДжскладывая тепловые эффекты двух последовательных реакций в способе (2) мы получаем тот же тепловой эффект, что и для способа (1): 65 кДж + 69 кДж = 131 кДж

Ученый, чьим именем назван основной закон термохимии, несколько лет работал врачом в Иркутске; по учебнику, написанному им, учился Дмитрий МенделеевПо-настоящему его звали Гесс Герман Генрих. И немудрено — родился он в многонациональной Женеве, где говорили по-немецки столь же широко, как и на других языках. Однако вырос и до конца своих дней прожил в России, где его величали на славянский манер — Герман Иванович. Так что в историю науки он вошел русским ученым, хоть и с заморской фамилией. Герман Гесс стал мировым светилом. Что примечательно, не только благодаря острому уму, знаниям и интересу к химии, но и Сибири — Иркутску, Байкалу. Изучая наш край, он собрал богатый фактический материал и написал работу, представив которую в Санкт-Петербургскую академию наук, был сразу произведен в адъюнкты и продолжил исследования по части химии при этом авторитетном научном заведении: открыл лабораторию, проводил многочисленные опыты.

Герман Гесс считается основателем термохимии, он дал формулировку двух фундаментальных термохимических законов. Ученый сформулировал основной закон термохимии —являющийся приложением закона сохранения энергии к химическим процессам. Этот закон назвали его именем — закон Гесса.И еще один необычный факт биографии: в конце 1820-х — начале 1830-х годов Гесс учил химии цесаревича Александра, будущего императора Александра II. Уж не знание ли основ устройства материи помогло Александру стать настоящим реформатором?

это определенное свойство вещества, оно является мерой энергии, накапливаемой веществом при его образовании.Величина, характеризующая теплосодержание - D Н

Энтальпия и тепловой эффект противоположны по знаку При экзотермических реакциях, когда тепло выделяется, D Н отрицательно. При эндотермических реакциях (тепло поглощается) и D H положительно.

Как вычислить тепловой эффект реакции Тепловой эффект химической реакции равен разности суммы теплот образования продуктов реакции и суммы теплот образования исходных веществ (суммирование проводится с учетом числа молей веществ, участвующих в реакции, т. е. стехиометрических коэффициентов в уравнении протекающей реакции):DH = Hкон.- Hисх.

Функция характеризующая степень беспорядкаDSЧем больше частиц в системе, тем больше в системе беспорядкаТвердое вещество жидкость газСтепень беспорядка увеличивается ----->Вычислить изменения энтропии можно на основании справочных данных по формуле: DS =S кон.- Sисх.

Всякая химическая реакция характеризуется двумя энергетическими характеристиками:энтальпией (DH) и энтропией (DS).Для самопроизвольных реакций характерно стремление к уменьшению энергии за счет выделения ее в окружающую среду и к увеличению степени беспорядка.При вычислении Qр необходимо учитывать закон Гесса.

При соединении 18 г алюминия с кислородом выделяется 547 кДж теплоты. Составьте термохимическое уравнение этой реакции.РешениеСоставить уравнение. 3О2 + 4Аl = 2Аl2О3 + Х кДжВычислить количество вещества содержащего 18 г алюминия.n = m/M n (Аl) = 18г : 27г/моль =0,67 мольСоставить и решить пропорцию. При окислении 0,67 моль алюминия выделяется 547 кДж теплотыПри окислении 4 моль алюминия выделяется Х кДж теплотыХ = 4 •547 : 0,67 = 3265,67 кДжСоставим термохимическое уравнение этой реакции.3О2 + 4Аl = 2Аl2О3 + 2365 кДж

Изучить материал учебника параграф 12, выполнить задания № 2.6; приготовить сообщение из дополнительной литературы, составить суточный рацион питания для подростков.

Спасибо за внимание!