Презентация на тему: Почему протекают химические реакции

Почему протекают химические реакции Начала термодинамикиАвтор: Фельдман Людмила Валентиновна, учитель химии МБОУ СОШ им. А.М.Горького г.Карачева Брянской обл.

Первый закон термодинамики – закон сохранения энергии Энергия не возникает из ничего и не исчезает бесследно, а только переходит из одной формы в другую
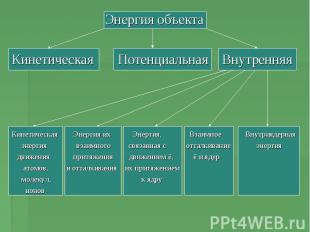
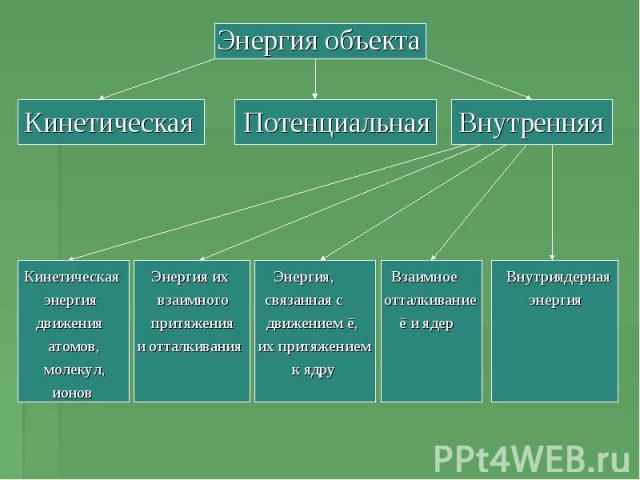
Энергия объектаКинетическая Потенциальная Внутренняя Кинетическая Энергия их Энергия, Взаимное Внутриядерная энергия взаимного связанная с отталкивание энергия движения притяжения движением ē, ē и ядер атомов, и отталкивания их притяжением молекул, к ядру ионов

Е реагентов > Е продуктовЭнергия выделяется в окружающую средуРеакции, при которых выделяется энергия и нагревается окружающая среда, называются экзотермическими.

Е реагентов < Е продуктовЭнергия поглощается из окружающей среды, температура системы понижаетсяРеакции, при протекании которых энергия поглощается из окружающей среды, называется эндотермической.

Энергия, которая выделяется или поглощается в химической реакции, называется тепловым эффектом реакции Тепловой эффект реакции выражается в кДж и его относят к тем количествам веществ, которые определены уравнением.Уравнение, в котором указан тепловой эффект реакции, называется термохимическим.2H2 + O2 = 2H2O + 484 кДж

Для расчета тепловых эффектов реакций используют значения величин теплот образования исходных веществ и продуктов реакции Теплота образования соединения (Qобр) – это тепловой эффект реакции образования одного моля соединения из простых веществ, устойчивых в стандартных условиях (25°С, 1 атм)При таких условиях теплота образования простых веществ равна 0.C + O2 = CO2 + 394 кДж теплоты образования 0,5N2 + 0,5O2 = NO – 90 кДж

Закон Гесса (1840) Тепловой эффект химической реакции не зависит от промежуточных стадий (при условии, что исходные вещества и продукты реакции одинаковы).С + O2 → CO2 + 394 кДж/моль (Q1)а) С + 0,5O2 → CO + ?(Q2) б) CO + 0,5O2 → CO2 + 284 кДж/моль(Q3)Q1 = Q2 + Q3 Q2 = Q1 – Q3 = 394 – 284 = 110 кДж

Следствие из закона Гесса Тепловой эффект химической реакции равен сумме теплот образования всех продуктов реакции минус сумма теплот образования всех реагентов (с учетом коэффициентов в уравнении реакции):Qр = ΣQобр(продукты) – ΣQобр(реагенты)
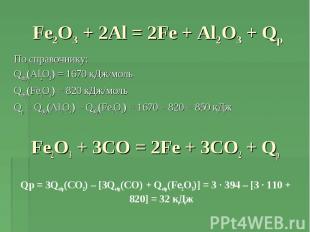
Fe2O3 + 2Al = 2Fe + Al2O3 + Qр По справочнику: Qобр(Al2O3) = 1670 кДж/мольQобр(Fe2O3) = 820 кДж/мольQр = Qобр(Al2O3) – Qобр(Fe2O3) = 1670 – 820 = 850 кДжFe2O3 + 3CO = 2Fe + 3CO2 + QрQр = 3Qобр(CO2) – [3Qобр(CO) + Qобр(Fe2O3)] = 3 · 394 – [3 · 110 + 820] = 32 кДж

Энтальпия (теплосодержание) – это величина, которая характеризует запас энергии в веществе. ΔH = ΣHпродукты – ΣHреагентыΔH = -QреакцииДля экзотермической реакции:Q > 0, ΔH < 0Для эндотермической реакцииQ < 0, ΔH > 0(ΔH обр – справочное значение)

Движущая сила реакций Для экзотермических реакций – стремление системы к состоянию с наименьшей внутренней энергией.Для эндотермических реакций – стремление любой системы в наиболее вероятному состоянию, которое характеризуется максимальным беспорядком, более высокой энтропией.Энтропия – мера хаоса.

Выводы Направление химической реакции определяется двумя факторами: стремлением к уменьшению внутренней энергии и стремлением к увеличению энтропии.Эндотермическую реакцию можно активировать, если она сопровождается увеличением энтропии.Энтропия увеличивается при повышении температуры и особенно при фазовых переходах.Чем выше температура, при которой проводят реакцию, тем большее значение будет иметь энтропийный фактор по сравнению по сравнению с энергетическим.

Возможность протекания реакций в зависимости от ΔH и ΔS

Энергия Гиббса (G) ΔG = ΔH – TΔST – абсолютная температураΔH – изменение энтальпии системыΔS – изменение энтропии системы Самопроизвольно протекают лишь те процессы, в которых энергия Гиббса уменьшаетсяΔG < 0 Процессы, при которых ΔG > 0 – невозможны.Если ΔG = 0, то есть ΔH = TΔS, значит в системе установилось равновесие.









![Fe2O3 + 2Al = 2Fe + Al2O3 + Qр По справочнику: Qобр(Al2O3) = 1670 кДж/мольQобр(Fe2O3) = 820 кДж/мольQр = Qобр(Al2O3) – Qобр(Fe2O3) = 1670 – 820 = 850 кДжFe2O3 + 3CO = 2Fe + 3CO2 + QрQр = 3Qобр(CO2) – [3Qобр(CO) + Qобр(Fe2O3)] = 3 · 394 – [3 · 110 + … Fe2O3 + 2Al = 2Fe + Al2O3 + Qр По справочнику: Qобр(Al2O3) = 1670 кДж/мольQобр(Fe2O3) = 820 кДж/мольQр = Qобр(Al2O3) – Qобр(Fe2O3) = 1670 – 820 = 850 кДжFe2O3 + 3CO = 2Fe + 3CO2 + QрQр = 3Qобр(CO2) – [3Qобр(CO) + Qобр(Fe2O3)] = 3 · 394 – [3 · 110 + …](https://fs1.ppt4web.ru/images/2810/75216/640/img9.jpg)