Презентация на тему: Химические реакции

5klass.net

Разминка НСl Н2SО4 НNО3 Н3РО4 СаСl2 Н2SiО3 Мg(NO3)2 НI К3РО4 НNO2 Cu(OH)2 Серная кислота Соляная кислота Азотная кислота Ортофосфорная кислота Хлорид кальция Метакремневая кислота Нитрат магния Иодоводородная кислота Ортофосфат калия Азотистая кислота Гидроксид меди (II) user - null

Актуализация знаний -Какие явления происходят в природе? -Что такое химическое явление? -Каковы признаки химических реакций? -Что такое химическое уравнение? -Какой закон лежит в основе составления химических уравнений? -Расставьте коэффициенты: Р + Н2 = РН3 Fe(NO3)3 + KOH = Fe(OH)3 + KNO3 WO3 + H2 = W + H2O

Эпиграф «Вопросов полон мир, - кто даст на них ответ?» О.Хайам.

Урок химии с элементами поиска в 8 классе «Основные типы химических реакций»

Цели урока: повторить сущность химических реакций; познакомиться с типами химических реакций: соединения и разложения; закрепить навыки составления уравнений химических реакций; выявить значение реакций соединения и разложения в природе и жизни человека.
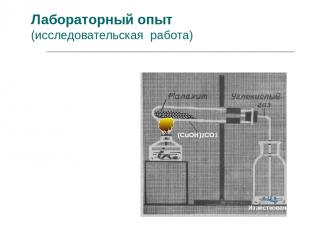
Лабораторный опыт (исследовательская работа) 1. Соберите прибор, согласно рисунку. 2. Нагрейте малахит. 3. Опишите наблюдаемые явления. 4. Сделайте вывод. Известковая вода Са(ОН)2 (СuОН)2СО3

(СuОН)2СО3 2СuО + Н2О + СО2 Это реакция разложения.

Значение реакций соединения и разложения в природе и жизни человека Разрушение меловых гор, образование сталактитов СаСО3 + СО2 + Н2О Са (НСО3)2
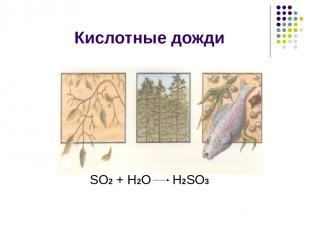
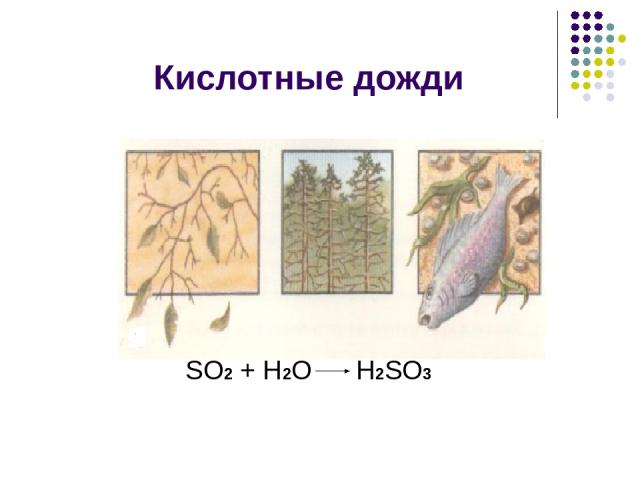
Кислотные дожди SО2 + Н2О Н2SО3

Кипячение воды в чайнике Мg(НСО3)2 МgСО3 + СО2 + Н2О

Брожение глюкозы в дрожжевом тесте дрожжи С6Н12О6 2 С2Н5ОН + 2 СО2 глюкоза этанол углекислый газ

Самостоятельная работа. Расставьте коэффициенты и отметьте известный вам тип реакции Уровень А а) Сг2О3 + Аl → Аl2О3 + Сг; б) HI → Н2 + I2; в) Al + S → Al2S3; г) Na2O + НСl → NaCl + Н2О. Уровень Б а) Mg + О2 →? б) Cu(OH)2 → CuO + Н2О в) Аl2О3 + Н2 →Аl + ? г) К2O + HCl →КCl + H2O Уровень В а) Cu + ? → Cu О; б) Аl(ОН)3 → Аl2О3 + ? в) Аl + ? → Al2S3; г) Cu О + ? → Cu + Н2О.

Уровень А а) Сг2О3 + 2Аl → Аl2О3 + 2Сг; б) 2HI → Н2 + I2; разложение в) 2Al + 3S → Al2S3; соединение г) Na2O + 2НСl → 2NaCl + Н2О. Уровень Б а) 2Mg + О2 → 2MgO соединение б) Cu(OH)2 → CuO + H2O разложение в) Аl2О3 + 3Н2 →2Аl + 3H2O г) К2O + 2HCl → 2KCI + H2O Уровень В а) 2Cu + O2 → 2CuO; соединение б) 2Аl(ОН)3 → Аl2О3 + 3H2O разложение в) 2Аl + 3S → Al2S3; г) Cu О + H2 → Cu + Н2О. Проверка

Задание на дом §32, упр. 2 а),г). Дом.эксперимент: газировка – это раствор угольной кислоты. Налейте в стакан газированной воды и оставьте на сутки. По истечение времени попробуйте ее на вкус. Сделайте вывод, напишите уравнение реакции и отметьте ее тип.