Презентация на тему: Скорость химической реакции. Факторы влияющие на скорость химических реакций

СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ ФАКТОРЫ ВЛИЯЮЩИЕ НА СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
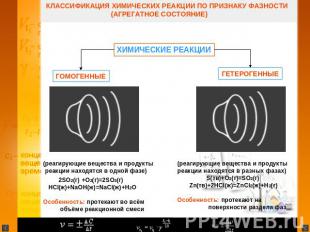
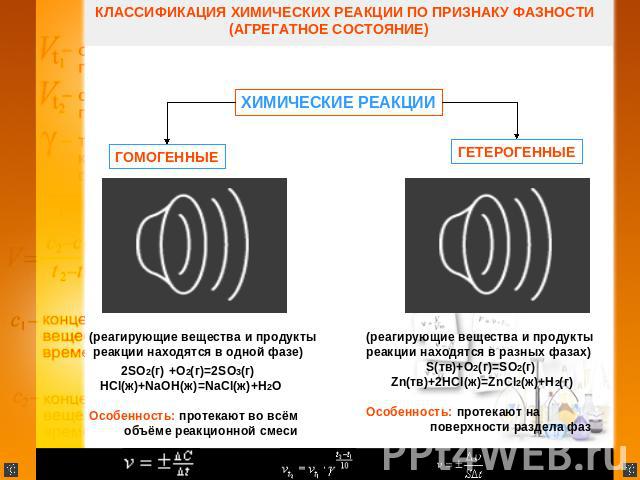
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИИ ПО ПРИЗНАКУ ФАЗНОСТИ (АГРЕГАТНОЕ СОСТОЯНИЕ) ХИМИЧЕСКИЕ РЕАКЦИИ ГОМОГЕТЕРОГЕННЫЕ ГЕННЫ(реагирующие вещества и продукты реакции находятся в одной фазе) 2SO2(г) +O2(г)=2SO3(г) HCl(ж)+NaOH(ж)=NaCl(ж)+H2O Особенность: протекают во всём объёме реакционной смеси (реагирующие вещества и продукты реакции находятся в разных фазах) S(тв)+O2(г)=SO2(г) Zn(тв)+2HCl(ж)=ZnCl2(ж)+H2(г) Особенность: протекают на поверхности раздела фаз

СКОРОСТИ РЕАКЦИЙ Скорость гомогенной реакции А (г) +В (г) = С (г) ∆V = V2-V1 ∆ t = t2-t1 V (гом) = ∆V /(∆ t * V) С = V / V (моль/л) V (гом) = ± ∆С/ ∆ t (моль/л*с) Скорость гетерогенной реакции V (гет) = ± ∆V /(S*∆ t ) (моль/м^2*с)
![Факторы влияющие на скорость химической реакции Концентрация А+B=C+D V=k[A]*[B] Факторы влияющие на скорость химической реакции Концентрация А+B=C+D V=k[A]*[B]](/images/150/8618/310/img3.jpg)
Факторы влияющие на скорость химической реакции Концентрация А+B=C+D V=k[A]*[B] Природа реагирующих веществ Площадь поверхности соприкосновения катализатор

Задача 1 Ответ: V = 0.008 (моль/л*с) В некоторый момент времени концентрация хлора в сосуде, в котором протекает реакция H2+Cl2=2HCl , была равна 0.06 моль/л. Через 5 сек. Концентрация хлора составила 0.02 моль/л. Чему равна средняя скорость данной реакции в указанный промежуток времени?

Задача 2 Как изменится скорость, протекающей в водном растворе, реакции FeCl3+3KCNS=Fe(CNS)3+3KCl при разбавлении реагирующей смеси водой в два раза

Задача 3 Как изменится скорость реакции при повышении температуры от 55 до 100 ‘С, если температурный коэффициент скорости этой реакции равен 2.5 ?

Задача 4 При повышении температуры на 30 ‘С, скорость некоторой реакции увеличивается в 64 раза. Чему равен температурный коэффициент скорости этой реакции?

Тест: закрепление знаний 1. Для уменьшения скорости реакции необходимо: а) увеличить концентрацию реагирующих веществ б) ввести в систему катализатор в) повысить температуру г) понизить температуру 2. С наибольшей скоростью протекает реакция: а) нейтрализации б) горение серы в воздухе в) растворение магния в кислоте г) восстановление оксида меди водородом

Тест: закрепление знаний 6. Укажите, как изменится скорость бимолекулярной газовой реакции 2NO2=N2O4 при увеличении концентрации NO2 в три раза. 7. Укажите какому процессу соответствует выражение закона действующих масс для скорости химической реакции V=k[O2]^x. 8. Отметьте, скорость какого процесса не изменится, если увеличить давление в реакционном сосуде ( t без изменения ). 9. Рассчитайте, чему равен температурный коэффициент скорости реакции, если при понижении температуры на 40’С её скорость уменьшилась в 81 раз.



![Факторы влияющие на скорость химической реакции Концентрация А+B=C+D V=k[A]*[B] Природа реагирующих веществ Площадь поверхности соприкосновения катализатор Факторы влияющие на скорость химической реакции Концентрация А+B=C+D V=k[A]*[B] Природа реагирующих веществ Площадь поверхности соприкосновения катализатор](/images/150/8618/640/img3.jpg)