Презентация на тему: Сера как химический элемент и простое вещество

Тема: сера как химический элемент и простое вещество. Цель: сформировать представление о аллотропии серы, её физических и химических свойствах.

Цель: сформировать представление о аллотропии серы, её физических и химических свойствах. 1.Истрия открытия и изучения серы. 2. Распространение серы в природе. 3. Аллотропия и физические свойства серы. 4.Химические свойства серы. 5.Применение серы человеком и её соединений.

История открытия Дата открытия – известна древним цивилизациям; Греческое название серы тейони (божественный, небесный) указывает на её легкую воспламеняемость, поскольку огонь считался принадлежностью богов. С какой целью серу применяли в древности? (стр.133)

Сера в природе Самородная сера Сульфидная сера Сульфатная сера

Самородная сера

Сульфидная сера Пирит-FeS2 Fe 46,6%; S 53,4% Киноварь-HgS Hg 86,2%; S 13,8%

Сульфатная сера Гипс – CaSO4*2H2O Барит – BaSO4
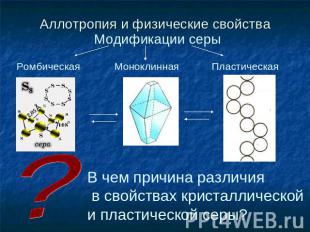
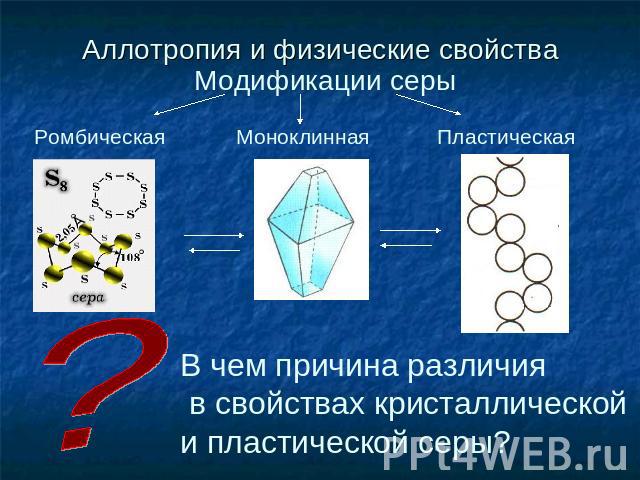
Аллотропия и физические свойства Модификации серы Ромбическая Моноклинная Пластическая В чем причина различия в свойствах кристаллической и пластической серы?

Какими свойствами – окислительными или восстановительными обладает сера?

Применение знаний: 1.Распределение электронов по энергетическим уровням в атоме серы: А. 2, 6. В. 2, 8, 6. Б. 2, 8. Г. 2, 8, 8. 2.Ряд формул веществ, в котором степень окисления серы уменьшается: А. SO3-FeS-SO2. В. SO2-S-H2S. Б. MgS-S-SO2. Г. S-H2S-Al2S3.

Применение знаний: 3.Свойство, характерное для серы: А.Хорошо растворима в воде. Б.Имеет металлический блеск. В.Твердое вещество желтого цвета. Г.Проводит электрический ток. 4. Уравнение реакции, в котором элемент сера является восстановителем: А. Fe+H2SO4=FeSO4+H2. Б. S+O2=SO2. В. 2Li+S=Li2S. Г. SO3+H2O=H2SO4

Домашнее задание:1.Стр.130-133 изучить.2.Составить уравнения реакций, при которых из простых веществ образуются сложные вещества: ZnS, Li2S, CS2. Какие свойства сера проявляет в этих реакциях? Спасибо за урок!