Презентация на тему: Химические свойства алканов

Химические свойства алканов Органическая химия 10 класс, школа №9 Иосифова Н.В. 5klass.net

CnH2n+2 Химическая устойчивость алканов объясняется высокой прочностью б - связей С-С и С-Н, а также их неполярностью. Неполярные связи С-С и С-Н не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированными серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями – перманганатом калия KMnO4 и т. п.
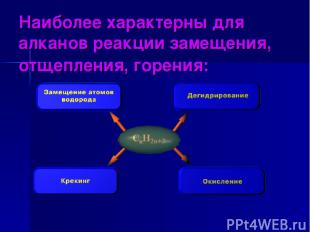
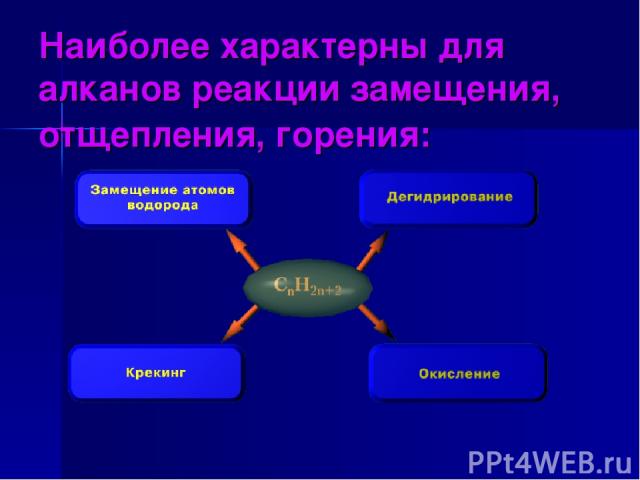
Наиболее характерны для алканов реакции замещения, отщепления, горения:

Реакции замещения. Протекают по механизму радикального замещения, обозначаемого Sr (англ. substitution radicalic). а) с галогенами (с Cl2 – на свету, с Br2 – при нагревании). hv трихлорметан (хлороформ) hv тетрахлорметан Хлорирование метана CH4 + Cl2 CH3Cl + HCl хлорметан CH3Cl + Cl2 hv CH2Cl2 + HCl дихлорметан CH2Cl2 + Cl2 hv CHCl3 + HCl CHCl3 + Cl2 CCl4 + HCl

Механизм реакции замещения Состоит из 3 стадий: -зарождение цепи Cl2 2Cl· -развитие цепи CH4 + Cl· свет ·CH3 + HCl -обрыв цепи ·CH3 ·CH3 + Cl2 CH3Cl + Cl· + Cl· CH3Cl 2Cl· Cl2 2·CH3 C2H6

Общая схема реакции Sr * Замещение у хлорметана идет легче, чем у метана, так как атом хлора поляризует связи С-Н и делает их реакционноспособными. * Замещение легче всего идет у третичного атома углерода, сложнее – у вторичного, первичного атомов.

Взаимодействие со фтором в) в атмосфере фтора происходит следующая реакция:

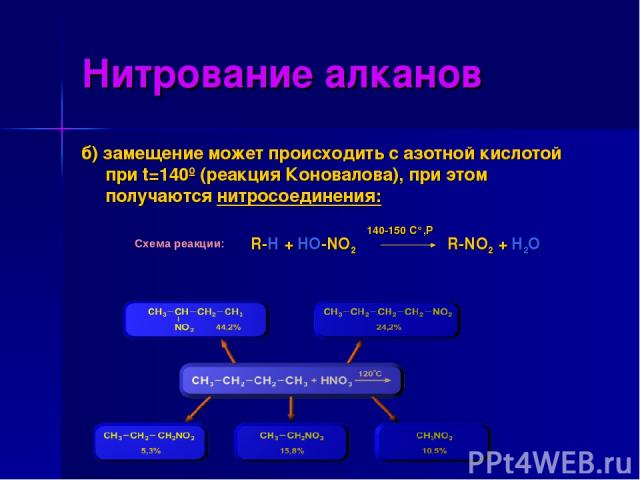
Нитрование алканов б) замещение может происходить с азотной кислотой при t=140º (реакция Коновалова), при этом получаются нитросоединения: Схема реакции: R-H + HO-NO2 140-150 C°,P R-NO2 + H2O

Реакции отщепления. а) дегидрирование: CH3 – CH3 Pt,t° CH2=CH2 + H2 б) крекинг алканов: CH3 – CH2 – CH2 – CH3 t° C2H6 + C2H4 в) полное термическое разложение: CH4 1000° C C + 2H2 г) для метана характерен пиролиз: 2CH4 C2H2 + 3H2 1500° C CnH2n+2 nC + (n +1)H2 этилен этан этен ацетилен

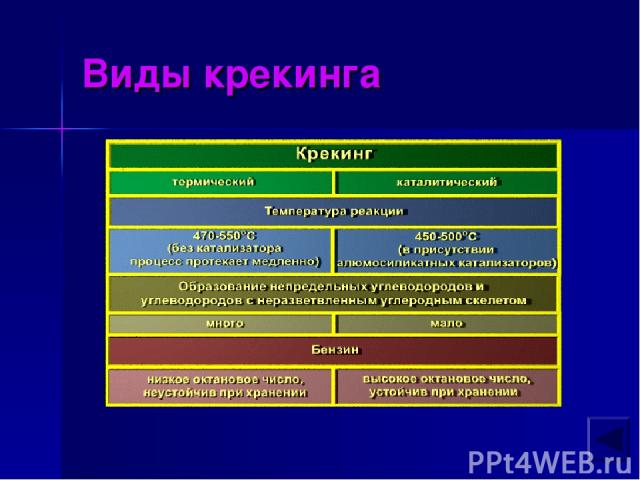
Крекинг алканов Крекинг – реакции расщепления углеродного скелета крупных молекул при нагревании и в присутствии катализаторов. При температуре 450 – 700 ° С алканы распадаются за счет разрыва связей С – С (более прочные связи С – Н при этом сохраняются) и образуются алканы и алкены с меньшим числом углеродных атомов. Распад связей происходит гомолитически с образованием свободных радикалов:
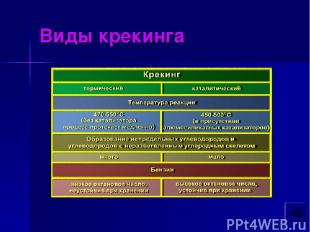
Виды крекинга

Реакции окисления. а) все алканы горят с образованием углекислого газа и воды : * б) при недостатке кислорода алканы могут сгорать до угарного газа или с образованием сажи (коптят): в) каталитически алканы могут окисляться с разрывом С – С связи примерно в середине молекулы:

Реакции изомеризации. Алканы подвергаются изомеризации при нагревании на катализаторе AlCl3 :

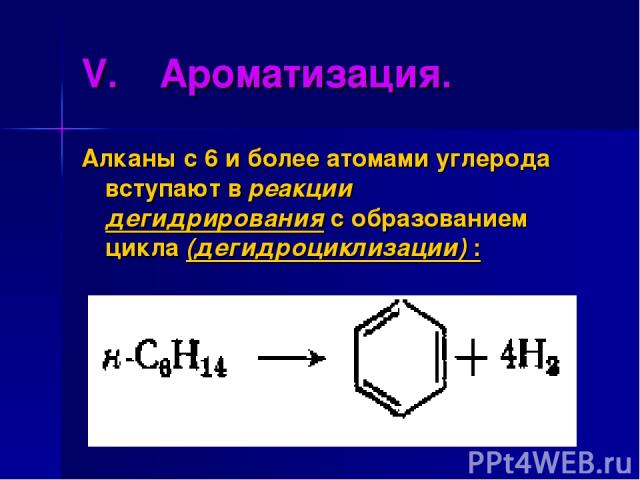
Ароматизация. Алканы с 6 и более атомами углерода вступают в реакции дегидрирования с образованием цикла (дегидроциклизации) :
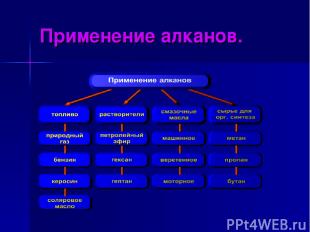
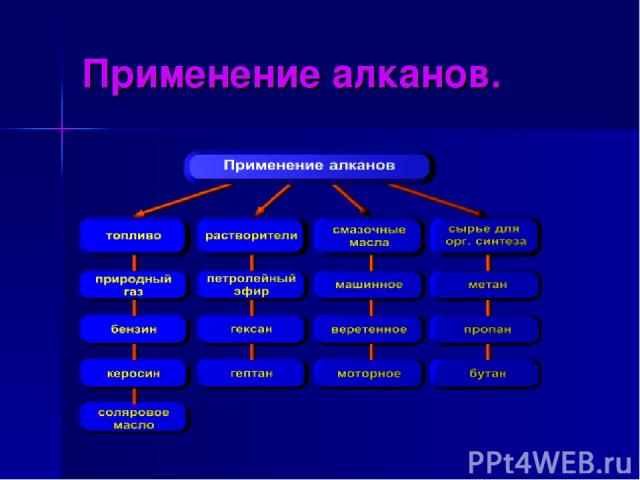
Применение алканов.