Презентация на тему: Химия неметаллов

Химия неметаллов
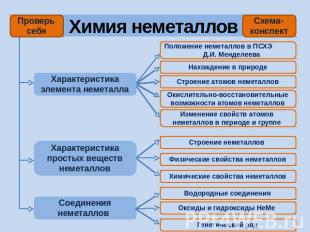
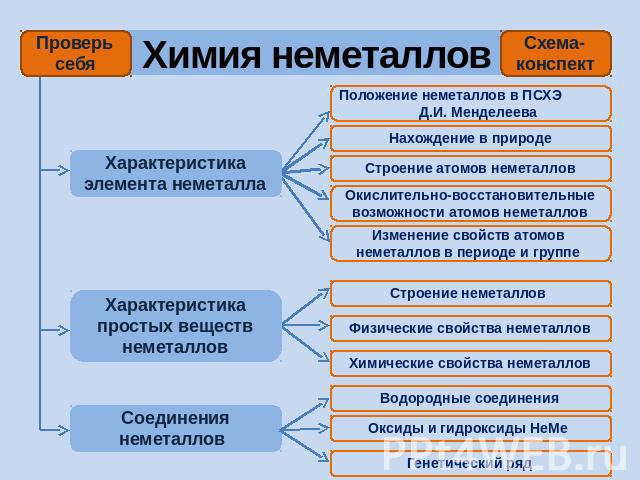
Химия неметаллов Характеристика элемента неметалла Характеристика простых веществ неметаллов Соединения неметаллов
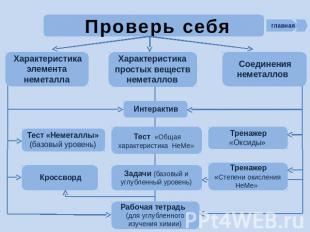
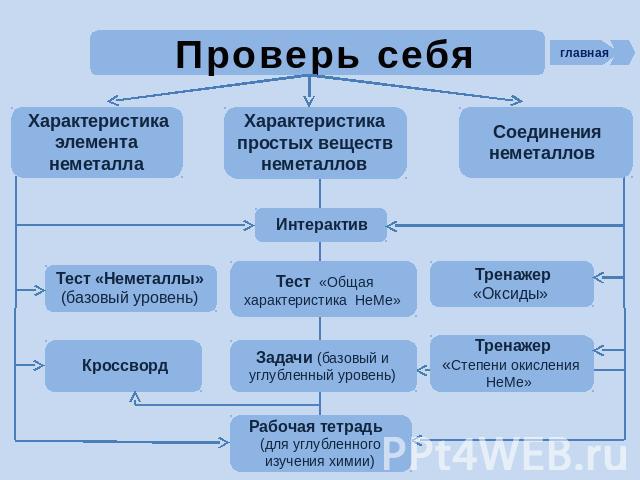
Проверь себя Характеристика элемента неметалла Характеристика простых веществ неметаллов Соединения неметаллов

Положение в ПСХЭ Д.И. Менделеева В ПСХЭ Д.И. Менделеева граница, отделяющая металлы от неметаллов, проходит по следующим неметаллам – элементам главных подгрупп: B; Si; As; Te; At. Неметаллы располагаются правее и выше этой границы.
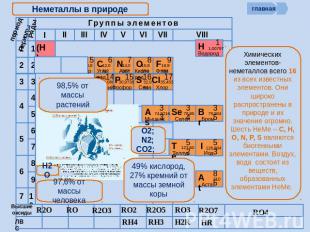
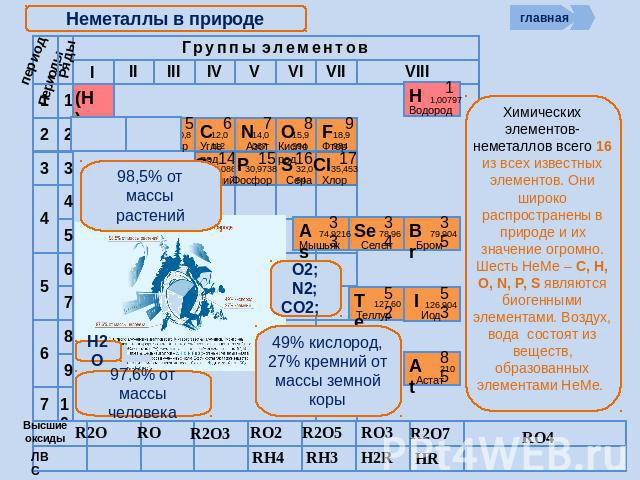
Неметаллы в природе Химических элементов-неметаллов всего 16 из всех известных элементов. Они широко распространены в природе и их значение огромно. Шесть НеМе – С, Н, О, N, P, S являются биогенными элементами. Воздух, вода состоят из веществ, образованных элементами НеМе.
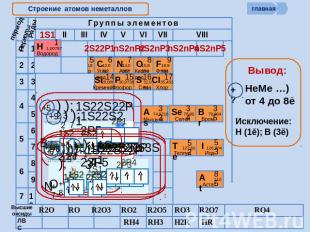
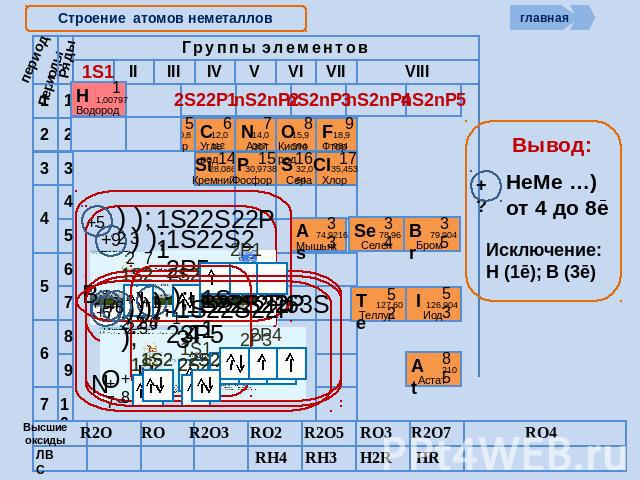
Cтроение атомов неметаллов

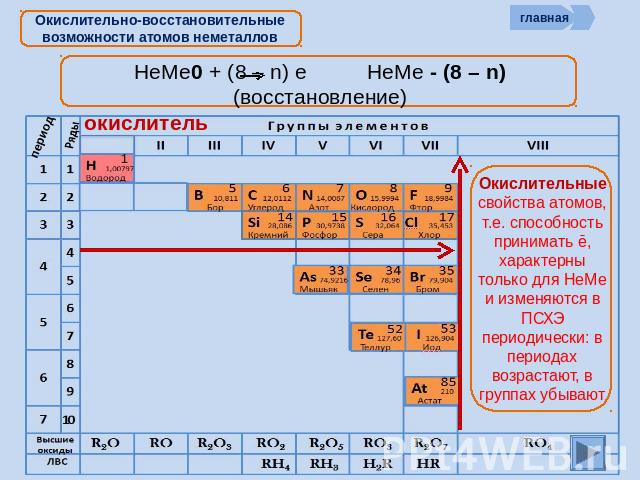
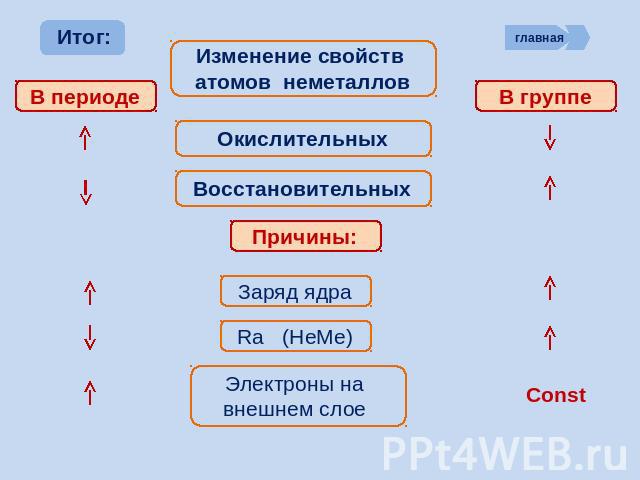
Окислительно-восстановительные возможности атомов неметаллов Окислительные свойства атомов, т.е. способность принимать ē, характерны только для НеМе и изменяются в ПСХЭ периодически: в периодах возрастают, в группах убывают
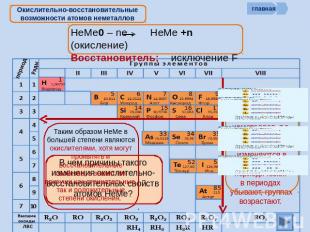
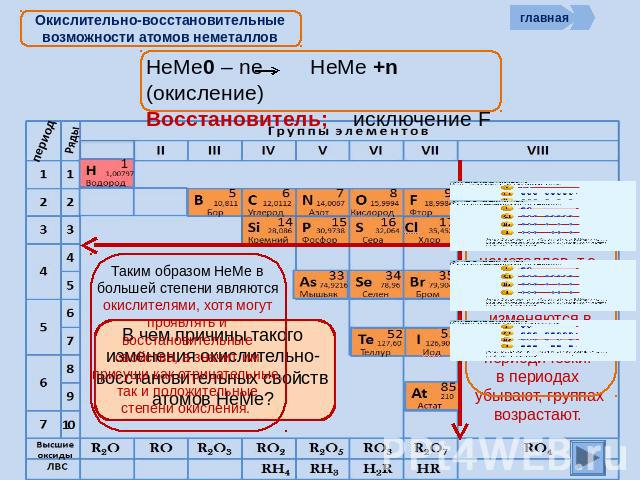
Окислительно-восстановительные возможности атомов неметаллов Восстановительные свойства атомов неметаллов, т.е. способность отдавать ē, изменяются в ПСХЭ периодически: в периодах убывают, группах возрастают. Таким образом НеМе в большей степени являются окислителями, хотя могут проявлять и восстановительные свойства, а значит им присущи как отрицательные, так и положительные степени окисления. В чем причины такого изменения окислительно-восстановительных свойств атомов НеМе?
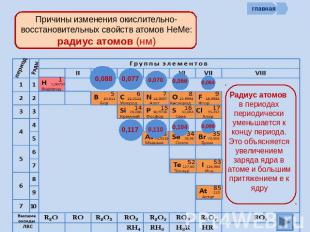
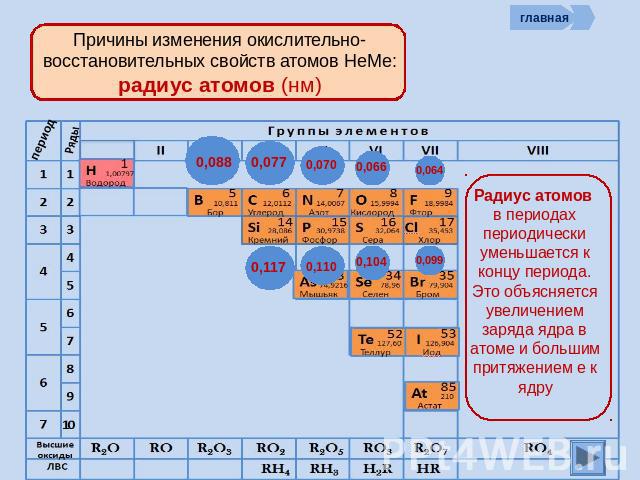
Причины изменения окислительно-восстановительных свойств атомов НеМе: радиус атомов (нм) Радиус атомов в периодах периодически уменьшается к концу периода. Это объясняется увеличением заряда ядра в атоме и большим притяжением е к ядру
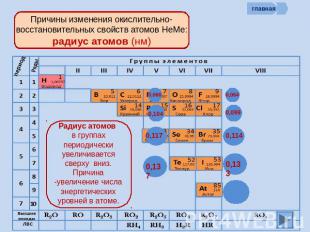
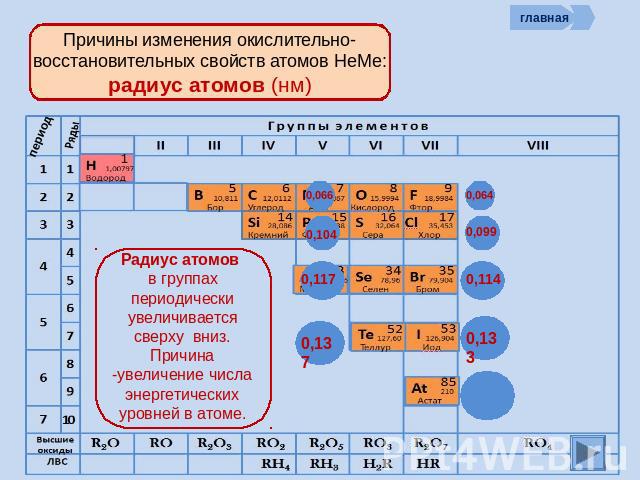
Причины изменения окислительно-восстановительных свойств атомов НеМе: радиус атомов (нм) Радиус атомов в группах периодически увеличивается сверху вниз. Причина -увеличение числа энергетических уровней в атоме.
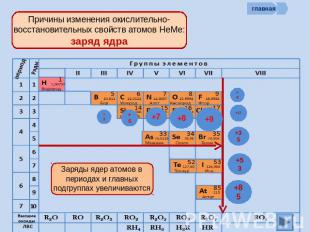
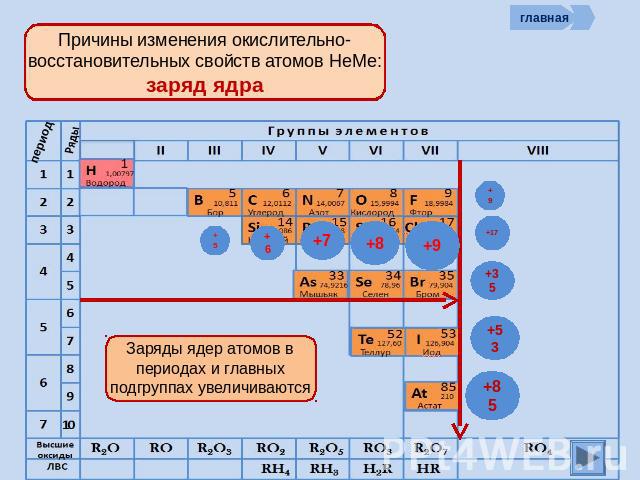
Причины изменения окислительно-восстановительных свойств атомов НеМе: заряд ядра Заряды ядер атомов в периодах и главных подгруппах увеличиваются
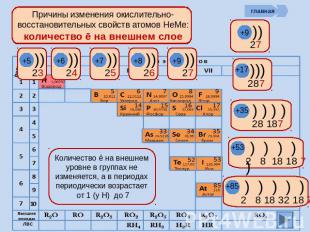
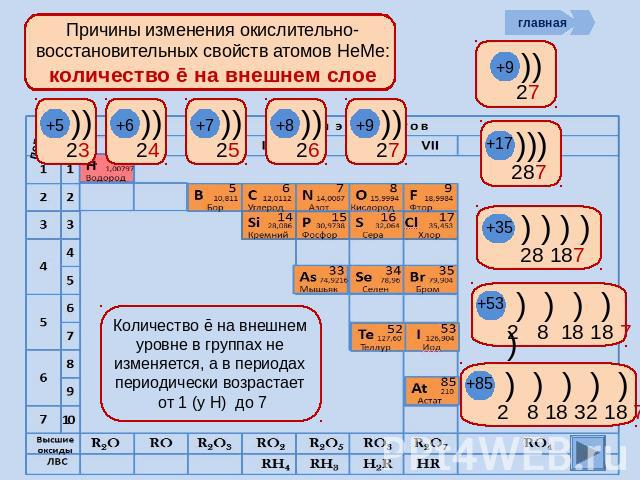
Причины изменения окислительно-восстановительных свойств атомов НеМе: количество ē на внешнем слое Количество ē на внешнем уровне в группах не изменяется, а в периодах периодически возрастает от 1 (у Н) до 7
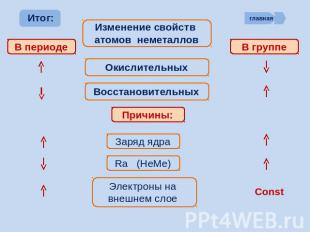
Изменение свойств атомов неметаллов Окислительных Восстановительных Причины: Заряд ядра Ra (НеМе) Электроны на внешнем слое
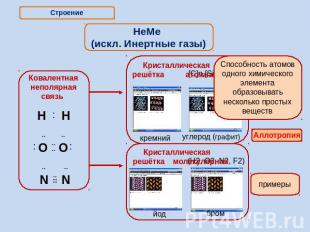
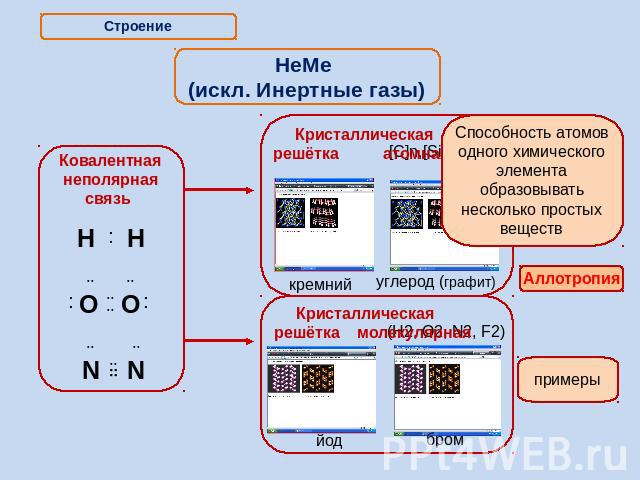
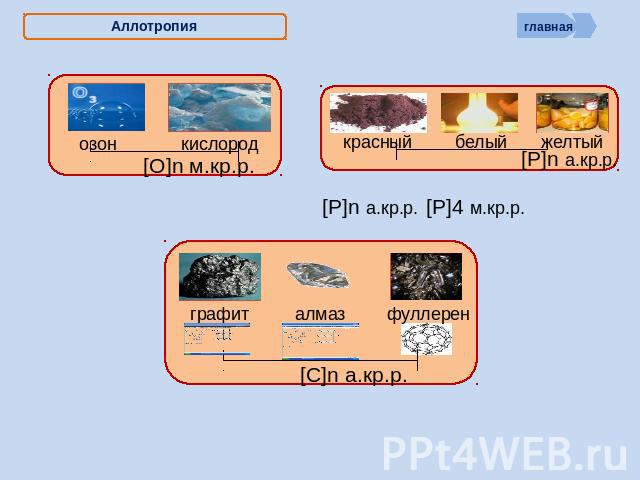
НеМе (искл. Инертные газы) Способность атомов одного химического элемента образовывать несколько простых веществ
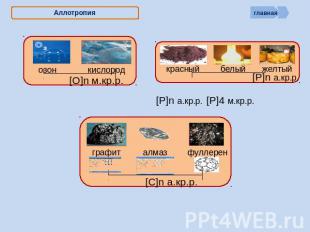
Аллотропия
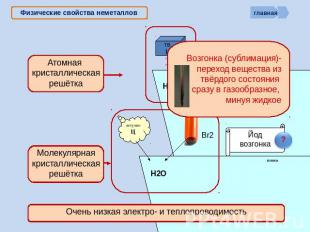
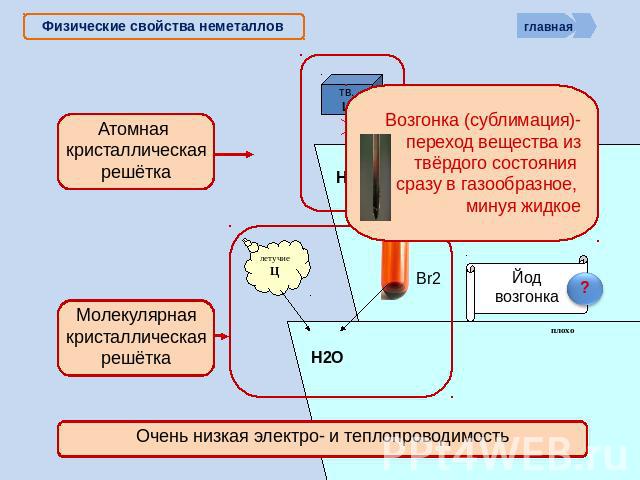
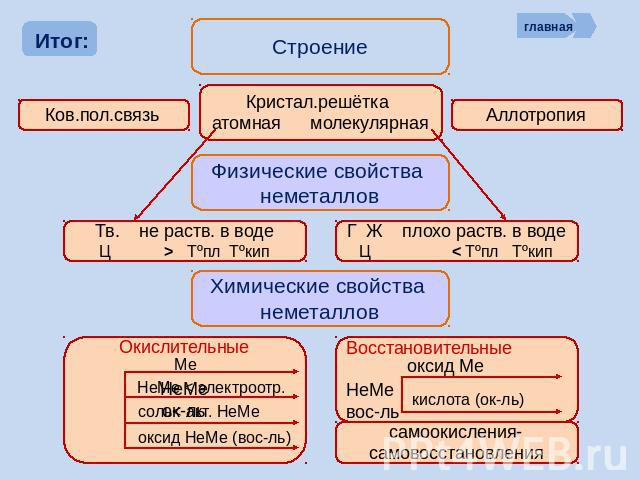
Физические свойства неметаллов Возгонка (сублимация)-переход вещества из твёрдого состояния сразу в газообразное, минуя жидкое Атомная кристаллическая решётка Молекулярная кристаллическая решётка Очень низкая электро- и теплопроводимость
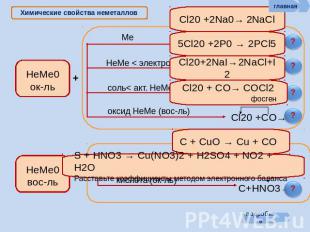
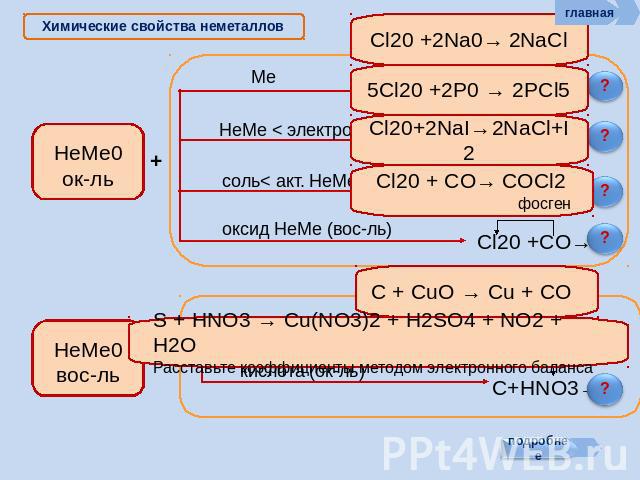
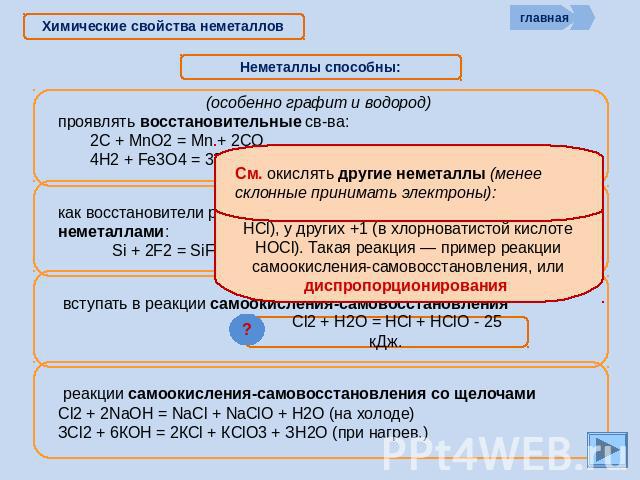
Химические свойства неметаллов

Химические свойства неметаллов Неметаллы могут:

Химические свойства неметаллов Неметаллы способны:
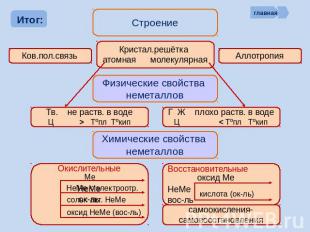
Строение
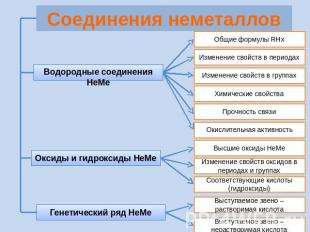
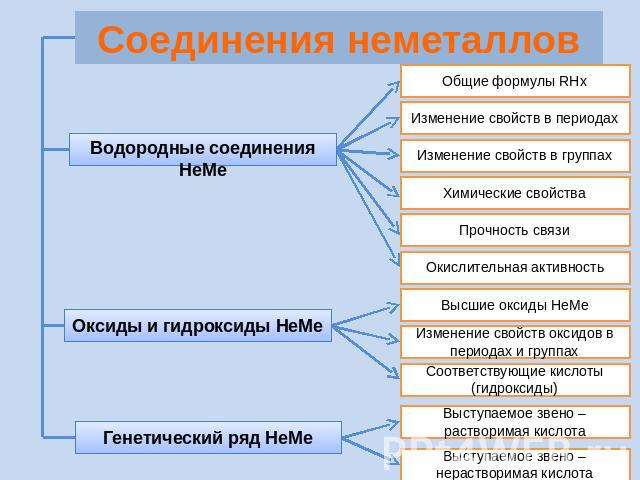
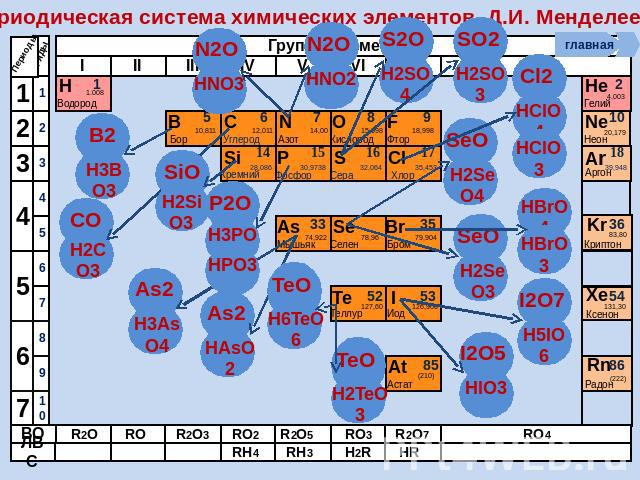
Соединения неметаллов
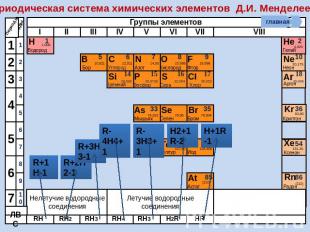
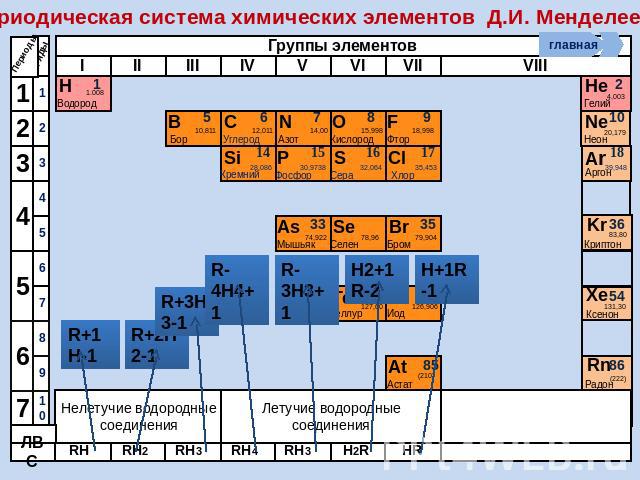
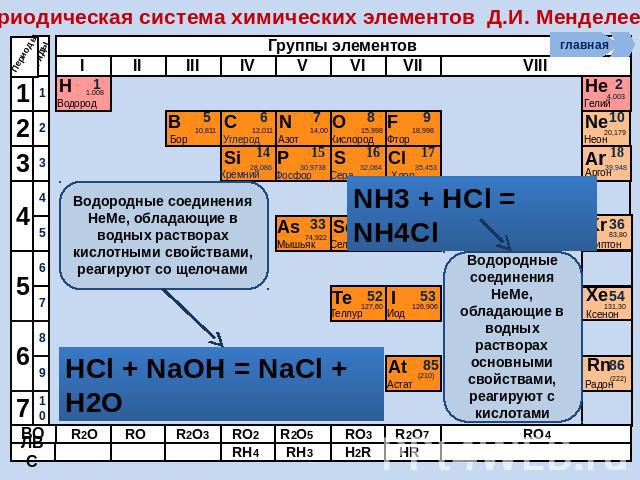
Периодическая система химических элементов Д.И. Менделеева
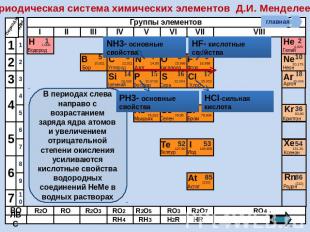
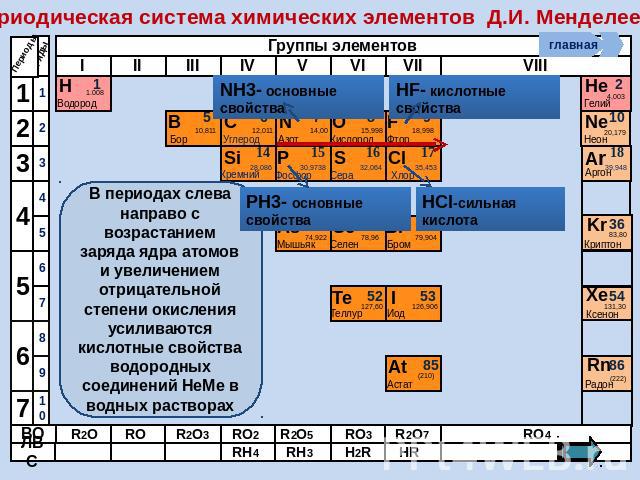
Периодическая система химических элементов Д.И. Менделеева В периодах слева направо с возрастанием заряда ядра атомов и увеличением отрицательной степени окисления усиливаются кислотные свойства водородных соединений НеМе в водных растворах

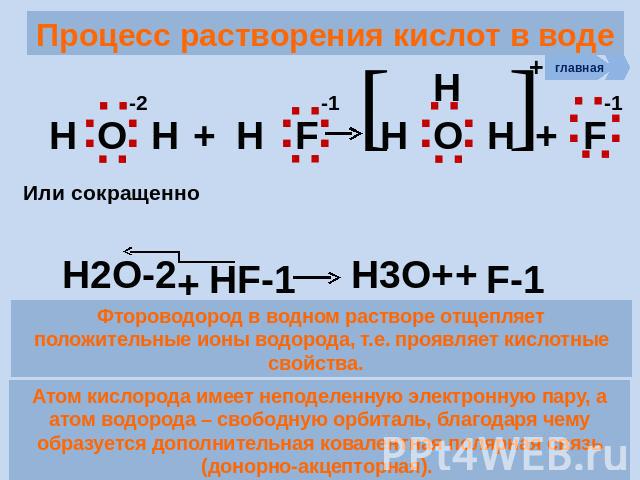
Процесс растворения кислот в воде Процесс растворения кислот в воде Процесс растворения кислот в воде
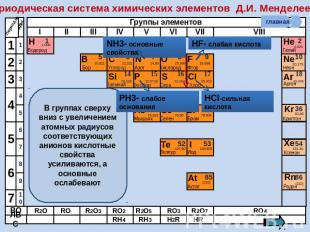
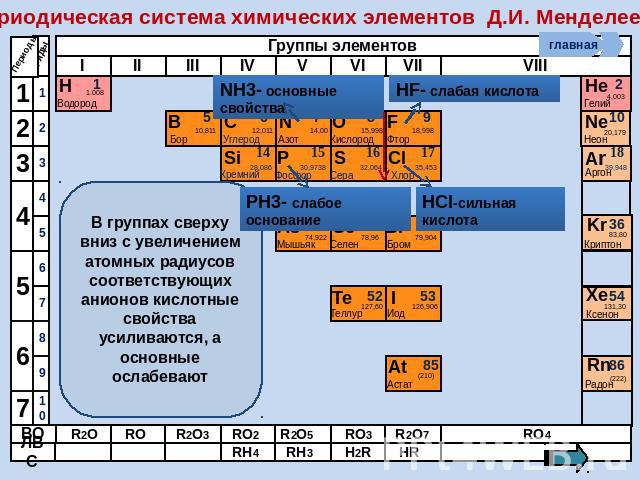
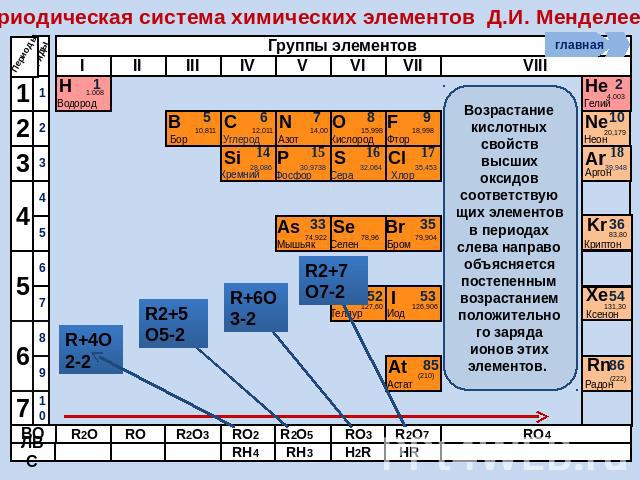
Периодическая система химических элементов Д.И. Менделеева В группах сверху вниз с увеличением атомных радиусов соответствующих анионов кислотные свойства усиливаются, а основные ослабевают
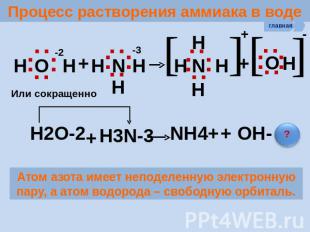
Процесс растворения аммиака в воде Атом азота имеет неподеленную электронную пару, а атом водорода – свободную орбиталь.
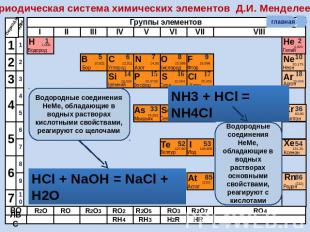
Периодическая система химических элементов Д.И. Менделеева Водородные соединения НеМе, обладающие в водных растворах кислотными свойствами, реагируют со щелочами Водородные соединения НеМе, обладающие в водных растворах основными свойствами, реагируют с кислотами
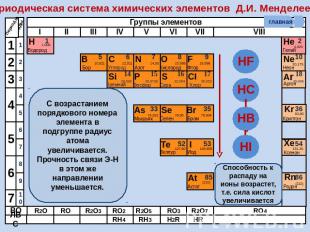
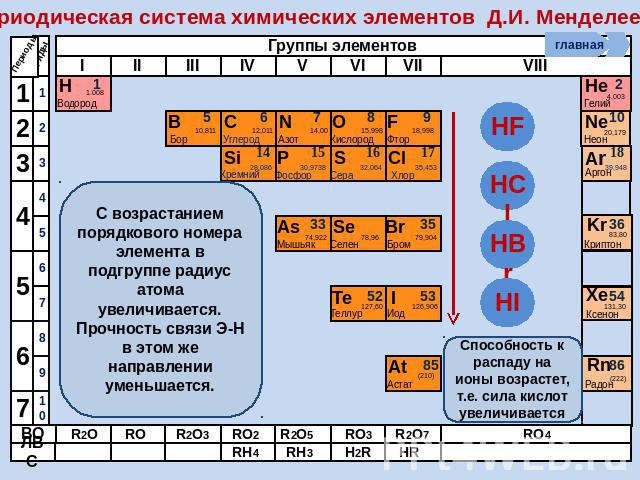
Периодическая система химических элементов Д.И. Менделеева С возрастанием порядкового номера элемента в подгруппе радиус атома увеличивается. Прочность связи Э-Н в этом же направлении уменьшается. Способность к распаду на ионы возрастет, т.е. сила кислот увеличивается
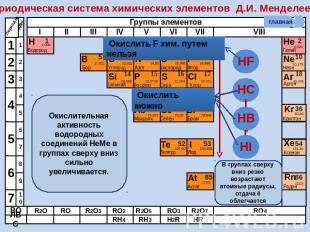
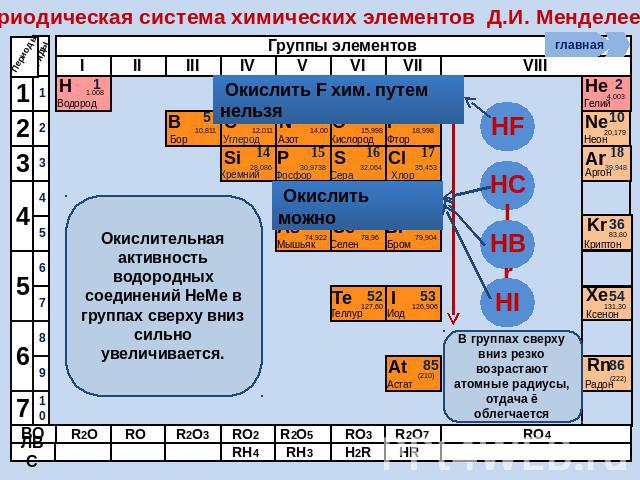
Периодическая система химических элементов Д.И. Менделеева Окислительная активность водородных соединений НеМе в группах сверху вниз сильно увеличивается. В группах сверху вниз резко возрастают атомные радиусы, отдача ē облегчается
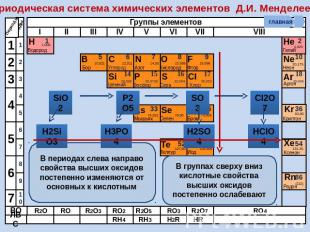
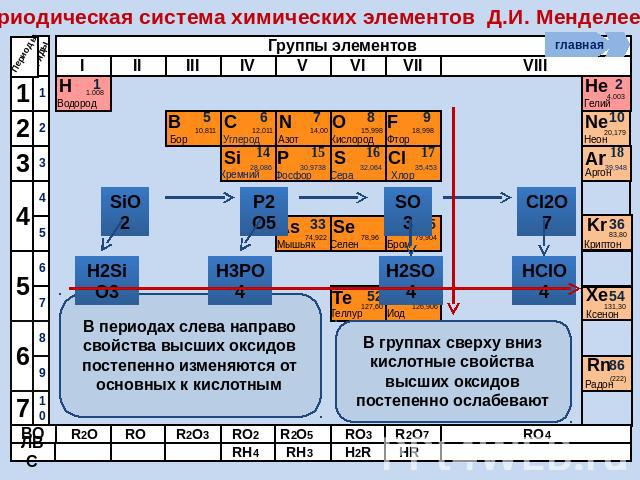
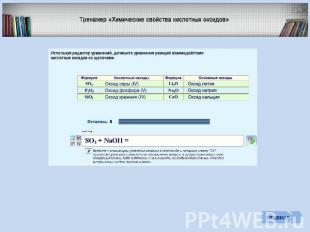
Периодическая система химических элементов Д.И. Менделеева В периодах слева направо свойства высших оксидов постепенно изменяются от основных к кислотным В группах сверху вниз кислотные свойства высших оксидов постепенно ослабевают
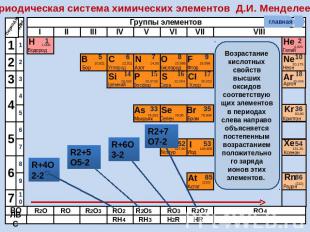
Периодическая система химических элементов Д.И. Менделеева Возрастание кислотных свойств высших оксидов соответствующих элементов в периодах слева направо объясняется постепенным возрастанием положительного заряда ионов этих элементов.
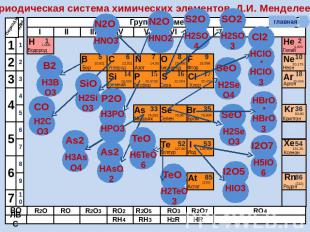
Периодическая система химических элементов Д.И. Менделеева

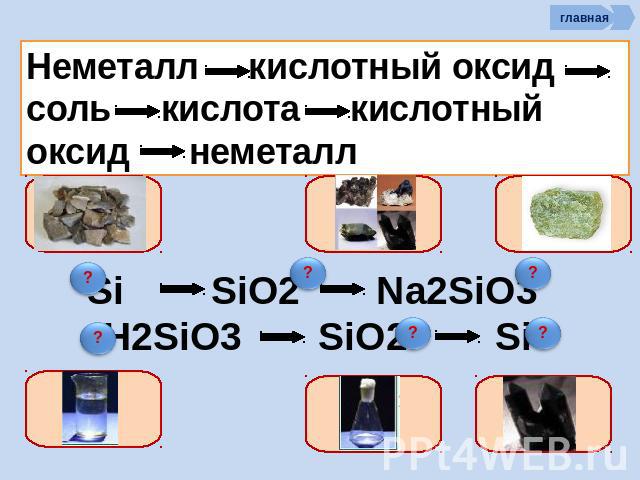
Неметалл кислотный оксид растворимая кислота cоль
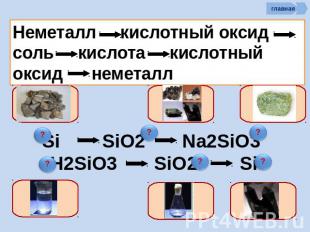
Неметалл кислотный оксид соль кислота кислотный оксид неметалл

Проверь себя Интерактив. Положение неметаллов в ПСХЭ Д.И. Менделеева: http://school-collection.edu.ru/catalog/res/d77a57b7-8cff-11db-b606-0800200c9a66/view/ Интерактив. Особенности строения атомов неметаллов: http://school-collection.edu.ru/catalog/res/d77a30ca-8cff-11db-b606-0800200c9a66/view/ Интерактив. Окислительные свойства неметаллов: http://school-collection.edu.ru/catalog/res/d77a57b8-8cff-11db-b606-0800200c9a66/view/ Интерактив. Оксиды и гидроксиды неметаллов: http://school-collection.edu.ru/catalog/res/d77a57ba-8cff-11db-b606-0800200c9a66/view/
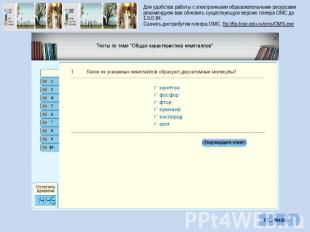
Для удобства работы с электронными образовательными ресурсами рекомендуем вам обновить существующую версию плеера ОМС до 1.0.0.84. Скачать дистрибутив плеера ОМС. ftp://ftp.fcior.edu.ru/oms/OMS.exe
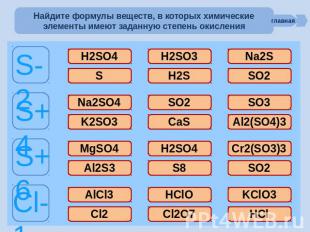
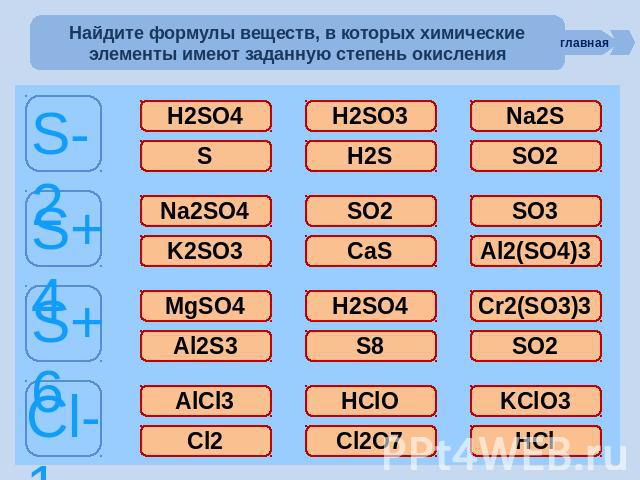
Найдите формулы веществ, в которых химические элементы имеют заданную степень окисления