Презентация на тему: Химия элементов - неметаллов Сера

Химия элементов - неметаллов Сера Автор: Цуркан Лилия Фёдоровнаучитель химии МОУ « ТСШ № 17» г. Тирасполь

Решаем загадки «Неметалы» Красив в кристаллах и парах, на детей наводит страх.Белый, воздуха боится, покраснел чтоб сохраниться.Хоть многие вещества превращает в яд, в химии она достойна всяческих наград.

Решаем загадки «Неметалы» Гость из космоса пришёл, в воздухе приют себе нашёл.Какой газ утверждает, что он - это не он?Какой неметалл является лесом?

Сера - химический элемент Каков химический знак?В какой группе периодической системы находится?В каком периоде находится?Какой атомный номер?Какая относительная атомная масса?Сколько электронов в атоме? Как располагаются электроны на АО?Какая электронная формула серы?Какие низшая (в соединениях с водородом и металлами) и высшая (в соединении с кислородом) валентности серы?

Сера в природе Сера является на 16-м месте по распространённости в земной коре. Встречается в свободном (самородном) состоянии и связанном виде.

Сера также встречается в виде сульфатов солей серной кислоты - мирабилит

Пирит - огненный камень (соединение серы в природе)

Сера в природе Сера входит в состав белков. Особенно много серы в белках волос, рогов, шерсти. Кроме этого сера является составной частью биологически активных веществ: витаминов и гормонов. При недостатке серы в организме наблюдается хрупкость и ломкость костей, выпадение волос.

Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца.

Физические свойства Твёрдое кристаллическое вещество желтого цвета, без запаха.Как и все неметаллы плохо проводит теплоту и не проводит электрический ток.Сера в природе практически не растворяется.Температура плавления 1200С.

Применение серы Серу применяют для производства :Серной кислотыВулканизации каучука Фунгицида в сельском хозяйстве Сера коллоидная - лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента - для получения серобетона.

Производство серной кислоты l стадия производства – обжиг: S + O2 =SO2 +297 кДж 4FeS2 + 11O2 = 8SO2 + 2Fe2O3 + 3400кДжll стадия производства- окисление сернистого газа: 2SO2 + O2= 2SO3 + 197 кДжlll стадия производства – растворение оксида серы (Vl) в воде: SO3 + H2O = H2SO4 +Q

Выход продукта- отношение массы полученного вещества к теоретически достижимой массе.

Решим задачу: Сырье – пирит содержит 80% полезного вещества FeS2. При обжиге 1 т пирита было получено 800 кг сернистого газа. Определить выход продукта.

Стихотворение «Сера» Сера, сера, сера, эс.Тридцать два - атомный вес.Сера в воздухе сгорит,Мы получим ангидрид.Ангидрид её с водойСтанет серной кислотой. Запишите уравнения химических реакций, о которых идет речь в стихотворении.
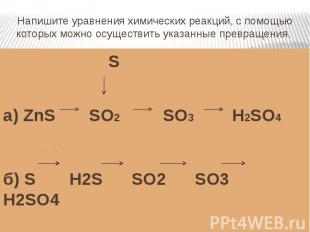
Напишите уравнения химических реакций, с помощью которых можно осуществить указанные превращения. Sа) ZnS SO2 SO3 H2SO4б) S H2S SO2 SO3 H2SO4

Задача: Каков объём (н.у.) а) сернистого газа получится при обжиге на воздухе 120г пирита FeS2;б) сероводорода получится при обработке 0,88 г сульфида железа (ll) соляной кислотой.

Домашнее задание § 19.1 ; задача № 15

за внимание!Спасибо