Презентация на тему: Соли азотной кислоты

Соли азотной кислоты

Номенклатура солейНитраты : Ba(NO₃)₂ , AgNO₃ , Zn(NO₃)₂ , NaNO₃Селитры : NaNO₃ , KNO₃ , Ca(NO₃)₂ , NH₄NO₃

Строение и физические свойства нитратов Тип химической связи – ионная Тип кристаллической решетки - ионная Агрегатное состояние – твердые кристаллические вещества Растворимость в воде – большинство растворимы

Химические свойства , общие с другими солями Электролиты Реакции с кислотами Ba(NO₃)₂ + H₂SO₄ со щелочами Fe(NO₃)₃ + NaOH с солями AgNO₃ + BaCl₂ с металлами Cu(NO₃)₂ + Fe

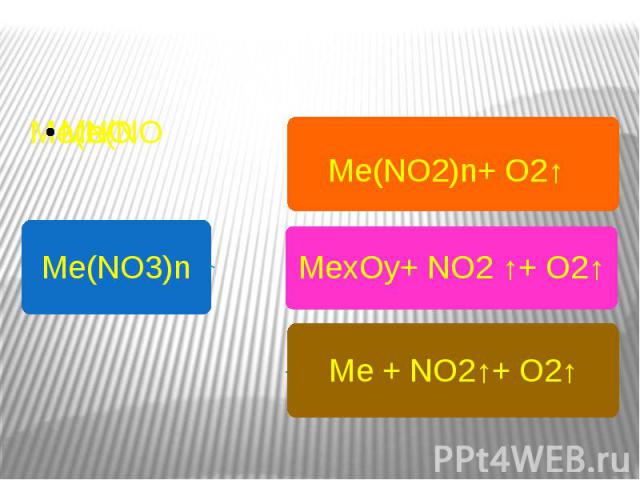
Особые свойства нитратов Термическое разложение Даром времени не тратя , Разберемся как нитраты В печке разлагаются .Что же получается ?Щелочной металл такой активный ,Он командным тоном говорит :«Быть нитратом - это так противно Лучше превращусь - ка я в нитрит!» А металлы из компании от магния до меди ,Цинк , железо и другие их соседи Осторожно и спокойно , без обид ,Из нитрата извлекают свой оксид .Ну а что же серебро и ртуть ?Металлы , что считают себя благородными , Желают стать совсем-совсем свободными .
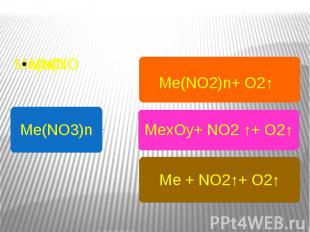
Me(NO3)nMe(NO2)n+ O2↑ MexOy+ NO2 ↑+ O2↑Ме + NO2↑+ O2↑

Особые свойства нитратов Качественная реакция на NO₃⁻ NaNO₃ + Cu + H₂SO₄

Нитраты : «за» и «против»


Таблица . Накопление нитратов в различных частях продуктивных органов растений.