Презентация на тему: Кислоты

Кислоты

Кислоты 1. Определение и классификация 2. Отдельные представители 3. Обнаружение кислот 4.Техника безопасности 5. Типичные реакции кислот 7. Проверка знаний
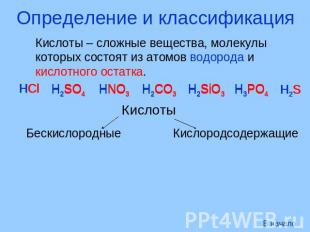
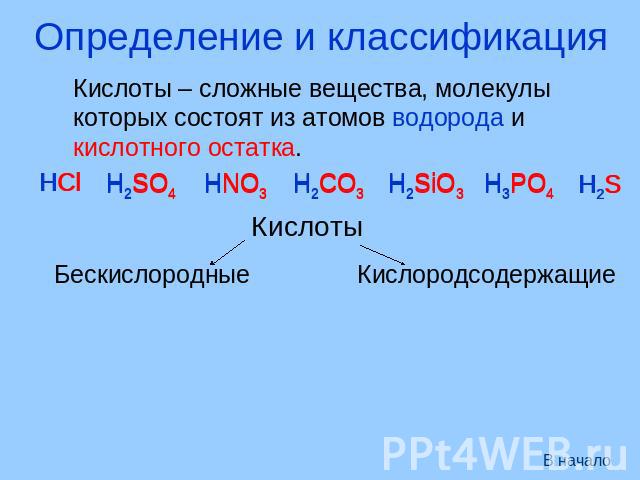
Определение и классификация Кислоты – сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка. Кислоты Бескислородные Кислородсодержащие
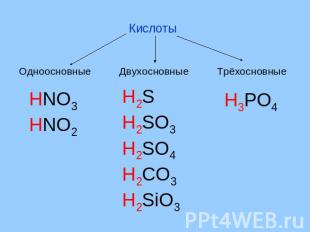
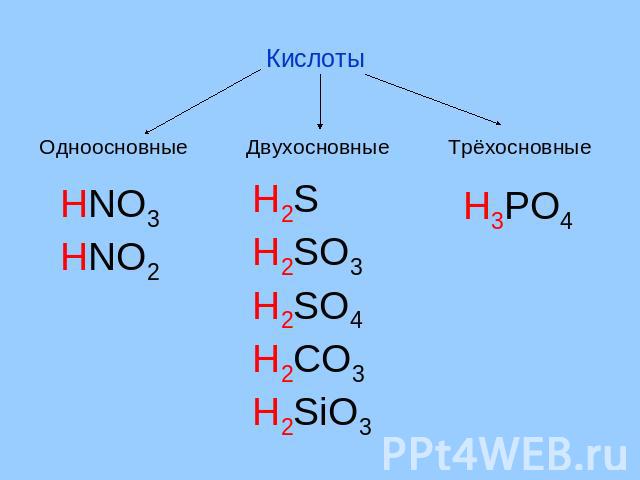
Кислоты Одноосновные Двухосновные Трёхосновные

Органические кислоты, встречаемые вами в повседневной жизни

Серная кислота Серная кислота – бесцветная жидкость, вязкая, как масло, не имеющая запаха, почти вдвое тяжелее воды. Серная кислота поглощает влагу из воздуха и других газов. Это свойство серной кислоты используют для осушения некоторых газов.

Угольная кислота УГОЛЬНАЯ КИСЛОТА - очень слабая и непрочная кислота. Образуется при растворении диоксида углерода в воде, например, в минеральной воде.

Соляная кислота СОЛЯНАЯ КИСЛОТА - бесцветная, «дымящая» на воздухе жидкость. Составная часть желудочного сока.

Обнаружение кислот Для кислот, также как и для щелочей, существуют качественные реакции с помощью которых растворы кислот можно распознать среди растворов других веществ. Это реакции кислот с индикаторами.

Техника безопасности При растворении серной кислоты нужно вливать её тонкой струёй в воду при помешивании

Типичные реакции кислот 1. Кислота + основание → соль + вода 2. Кислота + оксид металла → соль + вода 3. Кислота + металл → соль + водород 4. Кислота + соль → новая кислота + новая соль


Каким правилом техники безопасности пренебрёг лаборант?
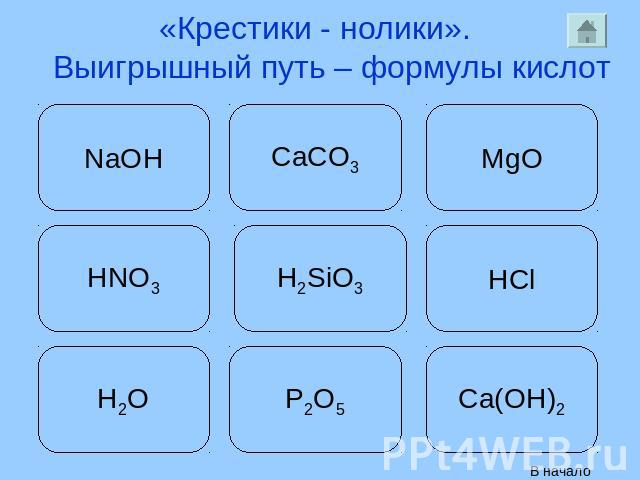
«Крестики - нолики». Выигрышный путь – формулы кислот