Презентация на тему: Карбоновые кислоты 11 класс

Карбоновые кислотыУрок химии в 11 классеАнтонова Е.Л.

План изучения темы: Определение.Классификация карбоновых кислот.Номенклатура .Изомерия.Физические свойства.

План изучения темы: 6. Химические свойства.7. Получение.8. Применение.9. Самостоятельная работа.10. Домашнее задание.

Карбоновые кислоты – это органические вещества, молекулы которых содержат одну или несколько карбоксильных групп(- СООН)

Классификация кислот: По числу карбоксильных групп делятся на одноосновные – НСООН – муравьиная кислота; двухосновные – НООС-СООН – щавелевая кислота, трехосновные и т.д.По типу углеводородного радикала они делятся на предельные, непредельные и ароматические.

Изомерия одноосновных карбоновых кислот Углеводородного радикала:СН3СН2СН2СООН – бутановая кислотаСН3СНСООН СН32-метилпропановая кислотаМежклассовая со сложными эфирами:СН3СН2СООН – пропановая кислотаСН3СООСН3 – метиловый эфир уксусной кислоты

Алгоритм составления названий карбоновых кислот Найдите главную (самую длинную) цепь углеродных атомов (включая атом карбоксильной группы).Пронумеруйте углеродные атомы главной цепи, начиная с углерода карбоксильной группы.Назовите соединение по алгоритму углеводородов.В конце названия допишите суффикс «ов», окончание «ая» и слово «кислота»

Физические свойства Наличие водородных связей между молекулами обусловливает высокие температуры кипения и хорошую растворимость в воде карбоновых кислот.

Химические свойства 1. Горение: СН3СООН +2О2=2СО2+2Н2О2. Свойства слабых кислот:a. Mg+2CH3COOH=(CH3COO)2Mg+H2b. CaO+2CH3COOH=(CH3COO)2Ca+H2Oc. NaOH+CH3COOH=CH3COONa+H2Od. K2CO3+CH3COOH=CH3COOK+H2O+CO2

Химические свойства 3. Этерификация (реакция со спиртами, приводящая к образованию сложного эфира):НСООН+С2Н5ОН=НСООС2Н5+Н2ОМуравьиная этанол этиловый эфир кислота муравьиной кислоты

Химические свойства: 4. Замещение в углеводородном радикале:СН3-СН2-СООН+Cl2=CH3-CHCl-COOH+HCL5. Качественная реакция на муравьиную кислоту – реакция серебряного зеркала:HCOOH+Ag2O=CO2+H2O+2Ag

Получение карбоновых кислот 1.Окисление альдегидов: kat, tRCHO+O2 2RCOOH(лабораторные окислители: Ag2O, Cu(OH)2, KMnO4 и др.)

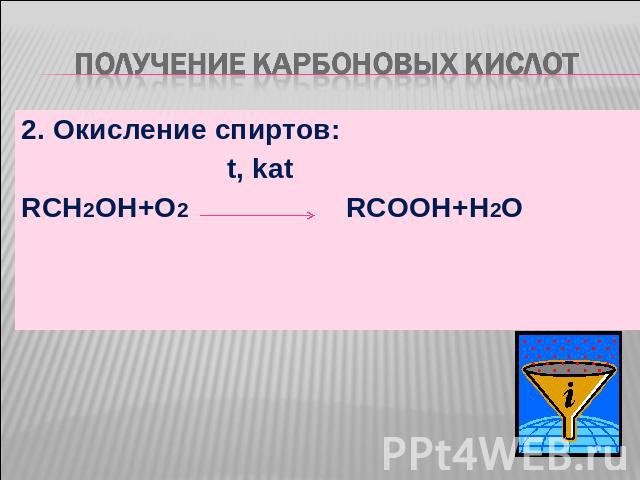
Получение карбоновых кислот 2. Окисление спиртов: t, katRCH2OH+O2 RCOOH+H2O

Получение карбоновых кисло т 3. Окисление углеводородов: t, kat 2С4Н10+5О2 4СН3СОН+2Н2О4. Из солей (лабораторный способ):CH3COONa+H2SO4=CH3COOH + NaHSO4Крист. Конц.

Применение карбоновых кислот:
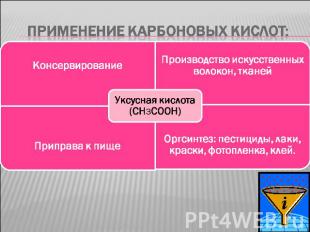
Применение карбоновых кислот:

Применение карбоновых кислот: Высшие карбоновые кислоты ( пальмитиновая – С15Н31СООН, стеариновая – С17Н35СООН и т.д.) называются жирными и входят в состав масел и жиров, взаимодействием их со щелочами получают мыло.

Самостоятельная работа: 1.Выписать формулы веществ, с которыми может вступать в реакцию уксусная кислота. (Са, СаО, СО2, Р2О5, СаСО3, Н2СО3)

2. Записать структурную формулу вещества - 2-метилгексановая кислота.

3. Назвать вещество - СН3-СН-СООН CH3

4. В пищевой промышленности уксусная кислота используется в качестве консерванта и регулятора кислотности под кодом Е-260. Напишите структурную формулу предыдущего гомолога этой кислоты, имеющего код Е- 236 . Назовите вещество.

Домашнее задание: Параграф 14 учебника. (Уровень А).Упражнения 5, 7, 8. (Уровень Б).Упражнения 6, 10. (Уровень С).

учебник Габриелян О.С. Химия. 10класс. Базовый уровень. – М.: Дрофа, 2007