Презентация на тему: Химическое равновесие. Факторы, влияющие на смещение равновесия

ХИМИЧЕСКОЕ РАВНОВЕСИЕ. ФАКТОРЫ, ВЛИЯЮЩИЕ НА СМЕЩЕНИЕ РАВНОВЕСИЯ.

Обратимые реакции 1) NaOH + HCl → NaCl + H2O;2) H2 + I2 → 2HI;3) C + O2 → CO2;4) CaCO3 + 2HCl → CaCl2 + CO2 + H2O.5) N2 + 3H2 → 2NH3 6) С6Н12 → С6Н6 + 3Н2

H2 + I2 2HI

1 ФАКТОР - ДАВЛЕНИЕ N2 + 3H2 ↔ 2NH3 1объем 3 объема 2 объема 4 объема 2 объема
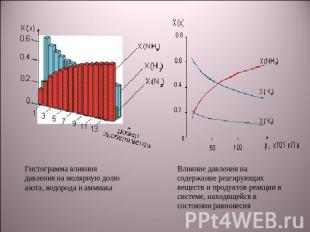
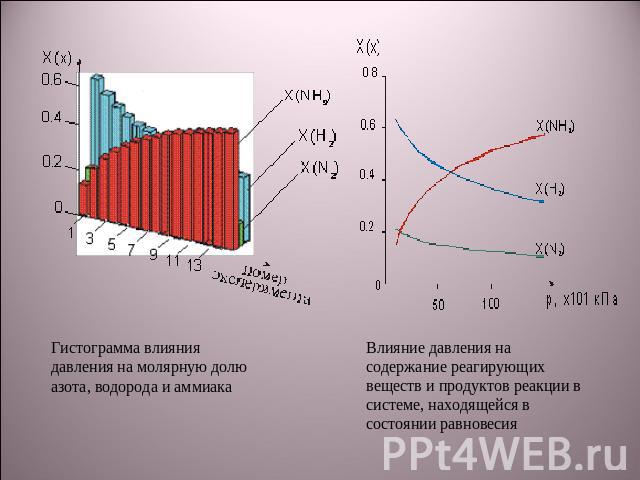
Гистограмма влияния давления на молярную долю азота, водорода и аммиакаВлияние давления на содержание реагирующих веществ и продуктов реакции в системе, находящейся в состоянии равновесия
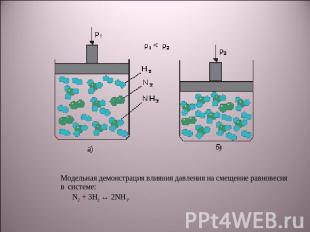
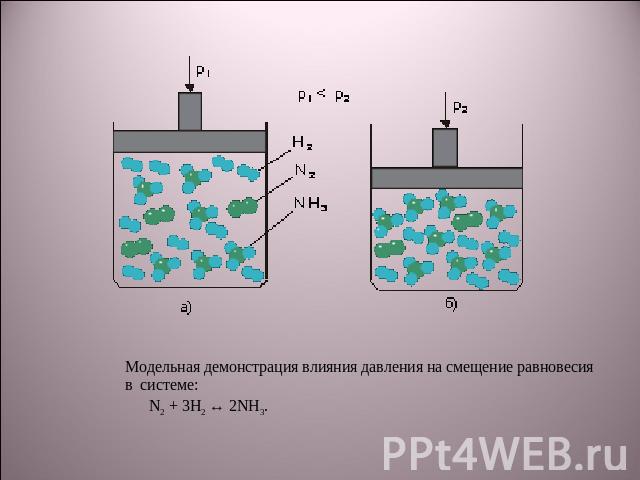
Модельная демонстрация влияния давления на смещение равновесия в системе: N2 + 3H2 ↔ 2NH3.

ДАВЛЕНИЕ Р ↑, смещается в сторону меньшего объема.Р ↓, смещается в сторону большего объема.

H2 + I2 ↔ 2HI
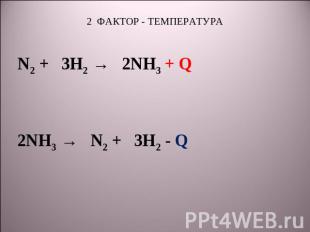
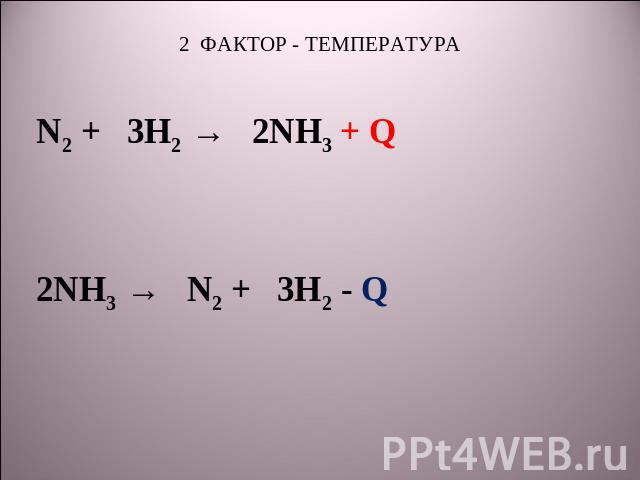
2 ФАКТОР - ТЕМПЕРАТУРА N2 + 3H2 → 2NH3 + Q 2NH3 → N2 + 3H2 - Q
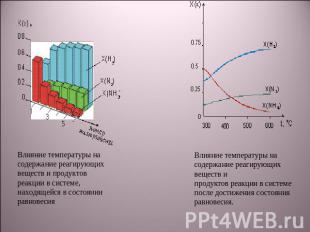
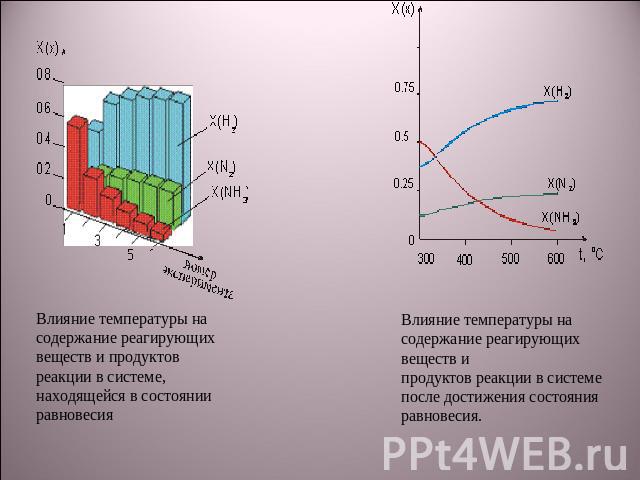
Влияние температуры на содержание реагирующих веществ и продуктов реакции в системе, находящейся в состоянии равновесияВлияние температуры на содержание реагирующих веществ и продуктов реакции в системе после достижения состояния равновесия.

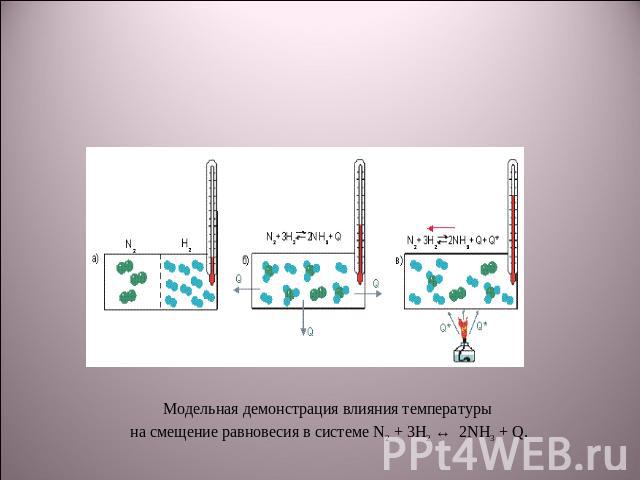
Модельная демонстрация влияния температуры на смещение равновесия в системе N2 + 3H2 ↔ 2NH3 + Q.

ТЕМПЕРАТУРА t↑, в сторону эндотермической реакции. t↓, в сторону экзотермической реакции.

3 ФАКТОР - КОНЦЕНТРАЦИЯ

КОНЦЕНТРАЦИЯ Концентрация реагентов ↑, в сторону продуктов.Концентрация продуктов ↑, в сторону реагентов.
![ФАКТОРЫ, ВЛИЯЮЩИЕ НА СИНТЕЗ АММИАКА N2 + 3H2 →2NH3 + QРt[N2 ], [H2] ФАКТОРЫ, ВЛИЯЮЩИЕ НА СИНТЕЗ АММИАКА N2 + 3H2 →2NH3 + QРt[N2 ], [H2]](/images/1402/40430/310/img15.jpg)
ФАКТОРЫ, ВЛИЯЮЩИЕ НА СИНТЕЗ АММИАКА N2 + 3H2 →2NH3 + QРt[N2 ], [H2]

ВЛИЯНИЕ КАТАЛИЗАТОРОВ НА РАВНОВЕСИЕ КАТАЛИЗАТОРЫ В РАВНОЙ СТЕПЕНИ УСКОРЯЮТ И ПРЯМУЮ И ОБРАТНУЮ , ИЗМЕНЯЯ ЭНЕРГИЮ АКТИВАЦИИ И ТОЙ И ДРУГОЙ НА ОДНУ И ТУЖЕ ВЕЛИЧИНУ

Анри Луи Ле Шателье (1850–1936) ПринципЛе-Шателье (принципсмещения хим.равновесия)(принцип противоложностей)был высказана в общем виде в 1884 году французским ученым. Ле Шателье А теоретически обоснован Ф. Брауном в 1887 г.

ПРИНЦИП ЛЕ-ШАТЕЛЬЕ Если на систему, находящуюся в равновесии оказывается воздействие (изменяется концентрация, давление, температура), то равновесие смещается в ту сторону, которая ослабляет данное воздействие.


«ВСЯКОЕ ЗНАНИЕ ИСХОДИТ ИЗ НАБЛЮДЕНИЯ И ОПЫТА» Ш. СЕНТ-БЕВ


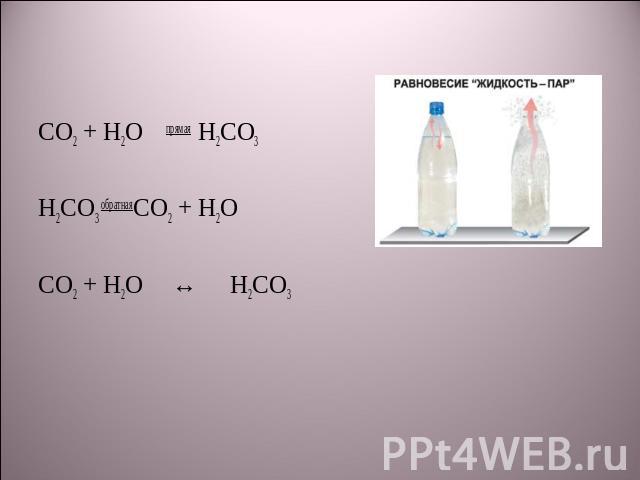
СО2 + Н2Опрямая Н2СО3 Н2СО3 обратнаяСО2 + Н2О СО2 + Н2О ↔ Н2СО3

УНИВЕРСАЛЬНОСТЬ ПРИПЦИПА В химии используется для увеличения выхода реакции; В фармакологии – для уточнения условий баланса биологической системы ; В экономике принцип позволяет объяснить равновесие цен в эффективных экономических системах; Принцип объясняет многие стороны живых систем и поведения человека как природной системы.

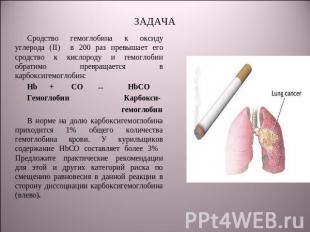
ЗАДАЧА Cродство гемоглобина к оксиду углерода (II) в 200 раз превышает его сродство к кислороду и гемоглобин обратимо превращается в карбоксигемоглобин:Hb + CO ↔ HbCOГемоглобин Карбокси- гемоглобинВ норме на долю карбоксигемоглобина приходится 1% общего количества гемоглобина крови. У курильщиков содержание HbCO составляет более 3% Предложите практические рекомендации для этой и других категорий риска по смещению равновесия в данной реакции в сторону диссоциации карбоксигемоглобина (влево).

ВЫВОДЫ Р ↑, смещается в сторону меньшего объема.Р ↓, смещается в сторону большего объема.t↑,в сторону эндотермической реакции. t↓, в сторону экзотермической реакции[ Концентрация реагентов ] ↑, в сторону продуктов.[ Концентрация продуктов] ↑, в сторону реагентов.

ДОМАШНЕЕ ЗАДАНИЕ §14 (Габриелян О.С.)Упр1,3,4 стр. 152.Где можно использовать полученные знания в жизни?

СПАСИБО ЗА ВНИМАНИЕ











![ФАКТОРЫ, ВЛИЯЮЩИЕ НА СИНТЕЗ АММИАКА N2 + 3H2 →2NH3 + QРt[N2 ], [H2] ФАКТОРЫ, ВЛИЯЮЩИЕ НА СИНТЕЗ АММИАКА N2 + 3H2 →2NH3 + QРt[N2 ], [H2]](/images/1402/40430/640/img15.jpg)








![ВЫВОДЫ Р ↑, смещается в сторону меньшего объема.Р ↓, смещается в сторону большего объема.t↑,в сторону эндотермической реакции. t↓, в сторону экзотермической реакции[ Концентрация реагентов ] ↑, в сторону продуктов.[ Концентрация продуктов] ↑, в стор… ВЫВОДЫ Р ↑, смещается в сторону меньшего объема.Р ↓, смещается в сторону большего объема.t↑,в сторону эндотермической реакции. t↓, в сторону экзотермической реакции[ Концентрация реагентов ] ↑, в сторону продуктов.[ Концентрация продуктов] ↑, в стор…](/images/1402/40430/640/img26.jpg)













