Презентация на тему: Личностно ориентированное обучение

Что может быть приятнеепередачи жадному ученикузнаний, которые дались тебе долгим и тяжким трудом? Т. Уайлдер.

Громова Ольга Ильинична Учитель химии МОУ «Лямбирская средняя общеобразовательная школа №1»Педстаж 25 летВысшая квалификационная категорияСоросовский учительПочётный работник общего образования РФПобедитель конкурса лучших учителей РФ

Педагогическая технология: Личностноориентированноеобучение

Педагогическая проблема ПРАКТИЧЕСКАЯ НАПРАВЛЕННОСТЬ НА УРОКАХ ХИМИИ

Цели: Научить решать расчётные и экспериментальные задачиПодготовка к олимпиадамПодготовка к экзамену в форме ЕГЭ

Задачи: Создание атмосферы заинтересованности каждого ученика в работе класса Стимулирование учащихся к высказываниям использованию различных способов выполнения заданий без боязни ошибиться, получить неправильный ответ и т.п. Использование в ходе урока дидактического материала, позволяющего ученику выбирать наиболее значимые для него вид и форму учебного содержания. Оценка деятельности ученика ни только по конечному результату (правильно - неправильно), но и по процессу его достижения. Поощрение стремления ученика находить свой способ работы (решения задачи), анализировать способы работы других учеников в ходе урока, выбирать и осваивать наиболее рациональные. Создание педагогических ситуации общения на уроке, позволяющих каждому ученику проявлять инициативу, самостоятельность, избирательность в способах работы; создание обстановки для естественного самовыражения ученика
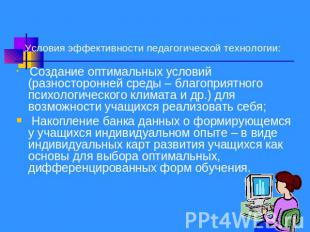
Условия эффективности педагогической технологии: Создание оптимальных условий (разносторонней среды – благоприятного психологического климата и др.) для возможности учащихся реализовать себя; Накопление банка данных о формирующемся у учащихся индивидуальном опыте – в виде индивидуальных карт развития учащихся как основы для выбора оптимальных, дифференцированных форм обучения.

Позиция педагога: Стимулирование «внутренних сил» саморазвития учащихся, инициирование личностного (субъектного) опыта каждого ученика; Развитие индивидуальности; Признание самобытности, неповторимости, самоценности каждого учащегося в коллективе.

Методика: Диалог в системе обучения, направленный на совместное конструирование программной деятельности по личностному развитию учащихся с учётом: 1)Мотивации деятельности; 2)Индивидуальной избирательности к содержанию, формам работы; 3)готовности к саморазвитию.
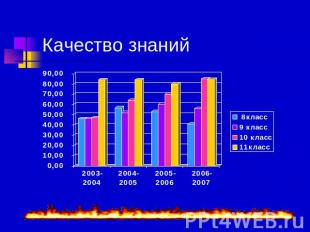
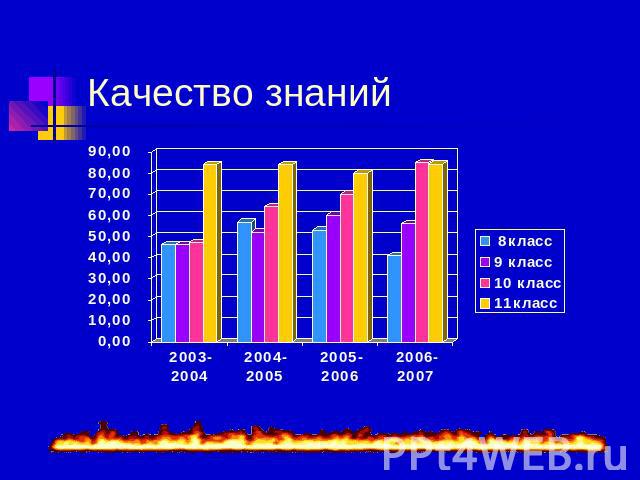
Качество знаний

Перспективы работы по проблеме. С учётом перехода общеобразовательных учреждений на пред профильную подготовку в 9 классе и профильное обучение в 10 – 11-х классах, встаёт задача разработки программ и содержания элективных курсов.

Задача на расчёт концентрации Задача №1. При смешении газообразных веществ А и В протекает химическая реакция 2А+В=2С+Д.Известно что через некоторое время после начала реакции концентрации веществ составили [А]=2моль/л: [В]=1моль/л; [С]=1,6моль/л. Вычислите исходные концентрации веществ.
![Решение [A]исх.= [A]p + [A]вст 1моль вступивших и получившихся веществ обозначим Решение [A]исх.= [A]p + [A]вст 1моль вступивших и получившихся веществ обозначим](/images/1402/41352/310/img12.jpg)
Решение [A]исх.= [A]p + [A]вст 1моль вступивших и получившихся веществ обозначим через Х.(концентрация равновесная и полученная- это одна и та же величина)Данные задачи и искомые величины сведём в таблицу. 2А + В = 2С + Д До реакции(исходные) 2Х+2 Х+1 ----- ---- Вступило 2Х Х ----- ---- Получилось ---- ---- 2Х ХОсталось 2 1 1,6 2Х=1,6; Х=0,8моль/л [А]исх.=2Х+2=1.6+2=3.6моль/л [В]исх.=Х+1=0,8+1=1,8моль/лОтвет. [А]исх.= 3.6моль/л, [В]исх=1,8моль/л

Задача на приготовление раствора при разной температуре Задача №2. Насыщенный при 60грС раствор соли в количестве 20кг был охлаждён снегом, какое количество соли выпало в осадок, если при 60грС растворимость соли составляет110г, а при 0грС -13,1г. Рассчитайте выход продукта в процентах.

Решение 60грС к.р.-----110г 0грС к.р.-------13,1г m(р-ра)20кг=2000г --------- -------->↓ ? 1.Приготовим стандартный раствор 4.Рассчитаем массу вещества. 100+110=220 растворённого в 95223,8гводы при 0г 2.Рассчитаем массу вещества в 2000г р-ра 110 Х ---- = -------; Х =10476,2г 220 20003.Ррассчитаем массу воды 100 95223,8 2000 -10476,2 = 95223,8 ------ = ------------; Х = 1247,6г 13,1 Х 5.Рассчитаем массу осадка 10476,2 – 1247,6 =9228,6г6. Выразим массу ↓ в %-тах 9228,6 η =---------- ×100%; η = 88,1% 10776,2 Ответ. η = 88,1%

Задача на водородный показатель Задача №3. Чему равна молярная концентрация растворов HNO3, если р Н =2?Для сильных электролитов [Н+]=СМ (молярной концентрации)ДАНО: РЕШЕНИЕ р Н(HNO3)=2 HNO3 = H++NO3-_____________ C(HNO3)=?т. к. кислота одноосновная [HNO3]=[H+]; p H =2, тогда [H+]= 0,02моль/л. [H+]=C, тогда С(HNO3)= 0,02моль/л Ответ: С(HNO3)= 0,02моль/л

Задача на Химическую термодинамику Задача №4. Реакция горения серы в оксиде азота(1) выражается термохимическим уравнением.S(К)+ 2N2O(Г)=SO2(Г)+2N2(Г)Вычислите энтальпию химической реакции.ΔН(N2O)=+81,55кд/моль; ΔН(SO2)=-297кд/моль. ΔН(простых в-в)=0ΔНХ.Р=∑ΔНпр-∑ΔНисх ΔНх.р.=ΔН(SО2)-ΔН(N2O); ΔНх.р.=-297-(+81,55)=-297-81,55=-460кДж

Задача на Закон действующих масс Задача №5.Как изменится скорость реакции 2NO(г) +O2(г) 2NO2(г), если уменьшить объём реакционного сосуда в 3 раза? При уменьшении объёма увеличивается концентрация. Объём и концентрация находятся в обратной пропорциональной зависимости.Применим закон действующих масс.
![Решение → →υпр.=R×[NO]2×[O2]; υ1=R×(3[NO])2×3[O2]= R9[NO]2×3[O2] =27R[NO]2×[O2]; Решение → →υпр.=R×[NO]2×[O2]; υ1=R×(3[NO])2×3[O2]= R9[NO]2×3[O2] =27R[NO]2×[O2];](/images/1402/41352/310/img18.jpg)
Решение → →υпр.=R×[NO]2×[O2]; υ1=R×(3[NO])2×3[O2]= R9[NO]2×3[O2] =27R[NO]2×[O2];← ← Vобр.=R×[NO2]2; v1 =R×(3[NO2])2; ←v1 =9R×[NO2]2;Концентрации твёрдых веществ в выражение закона действующих масс - не входят.











![Задача на расчёт концентрации Задача №1. При смешении газообразных веществ А и В протекает химическая реакция 2А+В=2С+Д.Известно что через некоторое время после начала реакции концентрации веществ составили [А]=2моль/л: [В]=1моль/л; [С]=1,6моль/л. В… Задача на расчёт концентрации Задача №1. При смешении газообразных веществ А и В протекает химическая реакция 2А+В=2С+Д.Известно что через некоторое время после начала реакции концентрации веществ составили [А]=2моль/л: [В]=1моль/л; [С]=1,6моль/л. В…](/images/1402/41352/640/img11.jpg)
![Решение [A]исх.= [A]p + [A]вст 1моль вступивших и получившихся веществ обозначим через Х.(концентрация равновесная и полученная- это одна и та же величина)Данные задачи и искомые величины сведём в таблицу. 2А + В = 2С + Д До реакции(исходные) 2Х+2 Х… Решение [A]исх.= [A]p + [A]вст 1моль вступивших и получившихся веществ обозначим через Х.(концентрация равновесная и полученная- это одна и та же величина)Данные задачи и искомые величины сведём в таблицу. 2А + В = 2С + Д До реакции(исходные) 2Х+2 Х…](/images/1402/41352/640/img12.jpg)


![Задача на водородный показатель Задача №3. Чему равна молярная концентрация растворов HNO3, если р Н =2?Для сильных электролитов [Н+]=СМ (молярной концентрации)ДАНО: РЕШЕНИЕ р Н(HNO3)=2 HNO3 = H++NO3-_____________ C(HNO3)=?т. к. кислота одноосновная… Задача на водородный показатель Задача №3. Чему равна молярная концентрация растворов HNO3, если р Н =2?Для сильных электролитов [Н+]=СМ (молярной концентрации)ДАНО: РЕШЕНИЕ р Н(HNO3)=2 HNO3 = H++NO3-_____________ C(HNO3)=?т. к. кислота одноосновная…](/images/1402/41352/640/img15.jpg)


![Решение → →υпр.=R×[NO]2×[O2]; υ1=R×(3[NO])2×3[O2]= R9[NO]2×3[O2] =27R[NO]2×[O2];← ← Vобр.=R×[NO2]2; v1 =R×(3[NO2])2; ←v1 =9R×[NO2]2;Концентрации твёрдых веществ в выражение закона действующих масс - не входят. Решение → →υпр.=R×[NO]2×[O2]; υ1=R×(3[NO])2×3[O2]= R9[NO]2×3[O2] =27R[NO]2×[O2];← ← Vобр.=R×[NO2]2; v1 =R×(3[NO2])2; ←v1 =9R×[NO2]2;Концентрации твёрдых веществ в выражение закона действующих масс - не входят.](/images/1402/41352/640/img18.jpg)